Бета окисление жирных кислот
Содержание
Бета окисление • ru.knowledgr.com

В биохимии и метаболизме, бета окисление — процесс catabolic, которым молекулы жирной кислоты сломаны на митохондрии, чтобы произвести ацетил-CoA, который входит в цикл трикарбоновых кислот, и NADH и FADH2, которые являются коэнзимами, используемыми в цепи переноса электронов. Это называют как таковым, потому что бета углерод жирной кислоты подвергается окислению карбонильной группе. Различные механизмы развились, чтобы обращаться с большим разнообразием жирных кислот.
Обзор
Катаболизм жирной кислоты состоит из:
- Активация и мембранный транспорт бесплатных жирных кислот, связывая с коэнзимом A.
- Окисление бета углерода карбонильной группе.
- Раскол сегментов с двумя углеродом, приводящих к ацетилу-CoA.
- Окисление ацетила-CoA к углекислому газу в цикле трикарбоновых кислот.
- Передача электрона от электронных перевозчиков до цепи передачи электрона в окислительном фосфорилировании.
Активация и мембранный транспорт
Бесплатные жирные кислоты не могут проникнуть ни через какую биологическую мембрану из-за их отрицательного заряда.
Бесплатные жирные кислоты должны пересечь клеточную мембрану через определенные транспортные белки, такие как семейный белок транспортировки жирной кислоты SLC27.
Однажды в цитозоли, следующие процессы приносят жирные кислоты в митохондриальную матрицу так, чтобы бета окисление могло иметь место.
- Длинная жирная кислота цепи — CoA ligase катализирует реакцию между жирной кислотой с ATP, чтобы дать жирный acyl adenylate плюс неорганический пирофосфат, который тогда реагирует с бесплатным коэнзимом, чтобы дать жирный сложный эфир acyl-CoA и УСИЛИТЕЛЬ.
- Если у жирного acyl-CoA есть длинная цепь, то шаттл карнитина должен быть использован:
- Acyl-CoA передан гидроксильной группе карнитина карнитином palmitoyltransferase I, расположен на цитозольных лицах внешних и внутренних митохондриальных мембран.
- Acyl-карнитин доставлен в челноке внутри карнитином-acylcarnitine translocase, как карнитин доставлен в челноке снаружи.
- Acyl-карнитин преобразован назад в acyl-CoA карнитином palmitoyltransferase II, расположен на внутреннем лице внутренней митохондриальной мембраны. Освобожденный карнитин доставлен в челноке назад к цитозоли, как acyl-карнитин доставлен в челноке в матрицу.
- Если жирный acyl-CoA содержит короткую цепь, эти жирные кислоты короткой цепи могут просто распространиться через внутреннюю митохондриальную мембрану.
Общий механизм
Как только жирная кислота в митохондриальной матрице, бета окисление происходит, раскалывая два углерода каждый цикл, чтобы сформировать ацетил-CoA. Процесс состоит из 4 шагов.
- Жирная кислота длинной цепи — dehydrogenated, чтобы создать сделку двойная связь между C2 и C3. Это катализируется дегидрогеназой acyl CoA, чтобы произвести трансдельту 2-enoyl CoA. Это использует ПРИЧУДУ в качестве электронного получателя, и это уменьшено до FADH2.
- Trans-delta2-enoyl CoA гидратируется немедленно связь, чтобы произвести L-B-hydroxyacyl CoA enoyl-CoA hydratase.
- L-B-hydroxyacyl CoA — dehydrogenated снова, чтобы создать B-ketoacyl CoA дегидрогеназой B-hydroxyacyl CoA. Этот фермент использует NAD в качестве электронного получателя.
- Thiolysis происходит между C2 и C3 (альфа и бета углерод) B-ketoacyl CoA. Фермент Thiolase катализирует реакцию когда новая молекула коэнзима разрывы связь нуклеофильным нападением на C3. Это выпускает первые две углеродных единицы как ацетил CoA и жирный acyl CoA минус два углерода. Процесс продолжается, пока весь углерод в жирной кислоте не превращен в ацетил CoA.
Жирные кислоты окислены большинством тканей в теле. Однако некоторые ткани, такие как надпочечный продолговатый мозг не используют жирных кислот для своих энергетических требований, но вместо этого используют углеводы.
Поскольку много жирных кислот не полностью насыщаются или не имеют четного числа углерода, несколько различных механизмов развили, описали ниже.
Четные влажные жирные кислоты
Однажды в митохондриях, каждый цикл β-oxidation, освобождая две углеродных единицы (ацетил-CoA), происходит в последовательности четырех реакций:
Этот процесс продолжается, пока вся цепь не расколота в ацетил отделения CoA. Заключительный цикл производит два отдельных ацетила CoAs вместо одного acyl CoA и одного ацетила CoA. Для каждого цикла единица Acyl CoA сокращена двумя атомами углерода. Concomitantly, одна молекула FADH, NADH и ацетила CoA созданы.
Влажные жирные кислоты с нечетным номером
В целом жирные кислоты с нечетным числом углерода найдены в липидах заводов и некоторых морских организмов. Много жвачных животных формируют большую сумму пропионата с 3 углеродом во время брожения углеводов в рубце.
Цепи с нечетным числом углерода окислены таким же образом как четные цепи, но конечные продукты — propionyl-CoA и ацетил-CoA.
Propionyl-CoA сначала карбоксилируется, используя ион бикарбоната в D-стереоизомер methylmalonyl-CoA в реакции, которая включает кофактор биотина, ATP и фермент propionyl-CoA carboxylase. Углерод иона бикарбоната добавлен к среднему углероду propionyl-CoA, формируя D-methylmalonyl-CoA.
Однако структура D ферментативным образом преобразована в структуру L methylmalonyl-CoA epimerase, тогда это подвергается внутримолекулярной перестановке, которая катализируется methylmalonyl-CoA mutase (требующий B как коэнзим), чтобы сформировать succinyl-CoA.Сформированный succinyl-CoA может тогда войти в цикл трикарбоновых кислот.
Однако, тогда как ацетил-CoA входит в цикл трикарбоновых кислот, уплотняя с существующей молекулой oxaloacetate, succinyl-CoA входит в цикл как в руководителя самостоятельно.
Таким образом succinate просто добавляет к населению обращающихся молекул в цикле и не подвергается никакому чистому metabolization в то время как в нем.
Когда это вливание промежуточных звеньев цикла трикарбоновых кислот превышает требование cataplerotic (такой что касается аспартата или глутаматного синтеза), некоторые из них могут быть извлечены к gluconeogenesis пути, в печени и почках, через phosphoenolpyruvate carboxykinase, и преобразованы в бесплатную глюкозу.
Ненасыщенные жирные кислоты
β-Oxidation ненасыщенных жирных кислот излагает проблему, так как местоположение связи СНГ может предотвратить формирование trans-Δ связи. Эти ситуации обработаны еще двумя ферментами, Enoyl CoA isomerase или 2,4 редуктазами Dienoyl CoA.
Безотносительно структуры цепи углеводорода β-oxidation обычно происходит, пока acyl CoA (из-за присутствия двойной связи) не является соответствующим основанием для дегидрогеназы acyl CoA или enoyl CoA hydratase:
- Если acyl CoA будет содержать cis-Δ связь, то СНГ U 0394Enoyl CoA isomerase преобразует связь в trans-Δ связь, которая является регулярным основанием.
- Если acyl CoA содержит cis-Δ двойная связь, то ее дегидрирование приводит к 2,4-dienoyl промежуточному звену, которое не является основанием для enoyl CoA hydratase. Однако фермент 2,4 редуктазы Dienoyl CoA уменьшает промежуточное звено, используя NADPH, в сделку U 0394enoyl CoA. Как в вышеупомянутом случае, этот состав преобразован в подходящее промежуточное звено 3,2-Enoyl CoA isomerase.
Подводить итог:
- Двойные связи с нечетным номером обработаны isomerase.
- Четные двойные связи редуктазой (который устанавливает двойную связь с нечетным номером)
,
Бета окисление Peroxisomal
Окисление жирной кислоты также происходит в peroxisomes, когда цепи жирной кислоты слишком длинные, чтобы быть обработанными митохондриями. Те же самые ферменты используются в peroxisomes в качестве в митохондриальной матрице, и ацетил-CoA произведен.
Считается, что очень длинная цепь (больше, чем C-22) жирные кислоты, ветвился, жирные кислоты, некоторые простагландины и leukotrienes подвергаются начальному окислению в peroxisomes, пока octanoyl-CoA не сформирован, в котором пункте это подвергается митохондриальному окислению.
Одна значительная разница — то, что окисление в peroxisomes не соединено с синтезом ATP. Вместо этого высоко-потенциальные электроны переданы O, который приводит к HO. Это действительно вырабатывает тепло как бы то ни было. Каталаза фермента, найденная исключительно в peroxisomes, преобразовывает перекись водорода в воду и кислород.
Peroxisomal β-oxidation также требует ферментов, определенных для peroxisome и для очень длинных жирных кислот. Есть три основных отличия между ферментами, используемыми для митохондриального и peroxisomal β-oxidation:
- NADH, сформированный в третьем окислительном шаге, не может быть повторно окислен в peroxisome, так уменьшающие эквиваленты экспортируются в цитозоль.
- β-oxidation в peroxisome требует использования peroxisomal карнитина acyltransferase (вместо карнитина acyltransferase I и II используемый митохондриями) для перевозки активированной acyl группы в митохондрии для дальнейшего расстройства.
- Первый шаг окисления в peroxisome катализируется ферментом оксидаза acyl-CoA.
У
- β-ketothiolase, используемого в peroxisomal β-oxidation, есть измененная специфика основания, отличающаяся от митохондриального β-ketothiolase.
Окисление Peroxisomal вызвано диетой с высоким содержанием жира и применением hypolipidemic наркотиков как clofibrate.
Энергетический урожай
Урожай ATP для каждого цикла окисления теоретически в максимальном урожае 17, поскольку NADH производит 3 ATP, FADH2 производит 2, и полное вращение Цикла трикарбоновых кислот производит 12.
На практике это ближе к 14 ATP для полного цикла окисления как на практике, теоретический урожай не достигнут, это обычно ближе к 2,5 ATP за произведенную молекулу NADH, 1.
5 для каждой произведенной Молекулы FADH2, и это равняется 10 за цикл TCA (согласно отношению P/O), сломанный следующим образом:
Для четного насыщенного жира (C), n — 1 окисление необходимо, и заключительный процесс приводит к дополнительному ацетилу CoA. Кроме того, два эквивалента ATP потеряны во время активации жирной кислоты. Поэтому, совокупный урожай ATP может быть заявлен как:
: (n — 1) * 14 + 10 — 2 = полная ATP
или
:14n-6 (альтернативно)
Например, урожай ATP пальмитата (C, n = 8):
: (8 — 1) * 14 + 10 — 2 = 106 ATP
Представленный в табличной форме:
Для источников, которые используют большие производственные числа ATP, описанные выше, общим количеством была бы 129 ATP = {(8-1) *17+12-2} эквиваленты за пальмитат.
Бета окисление ненасыщенных жирных кислот изменяет урожай ATP из-за требования двух возможных дополнительных ферментов.
История и открытие
В 1904 немецкий химик Франц Кнооп объяснил шаги в бета окислении, кормя собак странными — и ровная цепь ω-phenyl жирные кислоты, такие как кислота ω-phenylvaleric и ω-phenylbutyric кислота, соответственно. Механизм бета окисления, т.е.
последовательное удаление двух углерода, был понят, когда это было обнаружено, что странная цепь ω-phenylvaleric кислота была усвоена к hippuric кислоте, и что ровная цепь ω-phenylbutyric кислота была усвоена к phenaceturic кислоте.
В это время любой механизм реакции, включающий окисление в бета углероде, был пока еще неизвестен в органической химии.
Клиническое значение
Есть по крайней мере 25 ферментов и определенные транспортные белки в β-oxidation пути. Из них, 18 были связаны с человеческой болезнью как врожденные ошибки метаболизма.
См. также
- Метаболизм жирной кислоты
- Беспорядок метаболизма жирной кислоты
Внешние ссылки
- Химическая логика позади метаболизма жирной кислоты в ufp.pt
- ДЖЕРЕМИ М. БЕРГ, ДЖОН Л. ТЫМОЦЗКО и биохимия ЛУБЕРТА СТРАЙЕРА, 2 002
- Мультипликации в brookscole.com
Для окисления жирных кислот существует свой путь
Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО2 и воды, тесно связанный с циклом трикарбоновых кислот и дыхательной цепью.
Этот путь называется β-окисление, т.к.
происходит окисление 3-го углеродного атома жирной кислоты (β-положение) в карбоксильную группу, одновременно от кислоты отщепляется ацетильная группа, включающая С1 и С2 исходной жирной кислоты.
Элементарная схема β-окисления
Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови или появляющиеся при липолизе собственных внутриклеточных ТАГ. Суммарное уравнение окисления пальмитиновой кислоты выглядит следующим образом:
Пальмитоил-SКоА + 7ФАД + 7НАД+ + 7Н2O + 7HS-KoA → 8Ацетил-SКоА + 7ФАДН2 + 7НАДН
Этапы окисления жирных кислот
1. Прежде, чем проникнуть в матрикс митохондрий и окислиться, жирная кислота должна активироваться в цитозоле. Это осуществляется присоединением к ней коэнзима А с образованием ацил-SКоА. Ацил-SКоА является высокоэнергетическим соединением. Необратимость реакции достигается гидролизом дифосфата на две молекулы фосфорной кислоты.
Ацил-SКоА-синтетазы находятся в эндоплазматическом ретикулуме, на наружной мембране митохондрий и внутри них. Существует широкий ряд синтетаз, специфичных к разным жирным кислотам.
Реакция активации жирной кислоты
2. Ацил-SКоА не способен проходить через митохондриальную мембрану, поэтому существует способ переноса жирной кислоты в комплексе с витаминоподобным веществом карнитином (витамин В11). На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I.
Карнитин-зависимый транспорт жирных кислот в митохондрию
Карнитин синтезируется в печени и почках и затем транспортируется в остальные органы. Во внутриутробном периоде и в первые годы жизни значение карнитина для организма чрезвычайно велико.
Энергообеспечение нервной системы детского организма и, в частности, головного мозга осуществляется за счет двух параллельных процессов: карнитин-зависимого окисления жирных кислот и аэробного окисления глюкозы.
Карнитин необходим для роста головного и спинного мозга, для взаимодействия всех отделов нервной системы, ответственных за движение и взаимодействие мышц. Существуют исследования, связывающие с недостатком карнитина детский церебральный паралич и феномен «смерти в колыбели«.
Дети раннего возраста, недоношенные и дети с малой массой особенно чувствительны к недостаточности карнитина. Эндогенные запасы у них быстро истощаются при различных стрессовых ситуациях (инфекционные заболевания, желудочно-кишечные расстройства, нарушения вскармливания).
Биосинтез карнитина недостаточен, а поступление с обычными пищевыми продуктами неспособно поддержать достаточный уровень в крови и тканях.3. После связывания с карнитином жирная кислота переносится через внутреннюю митохондриальную мембрану транслоказой. На внутренней стороне этой мембраны фермент карнитин-ацилтрансфераза II вновь образует ацил-SКоА, который вступает на путь β-окисления.
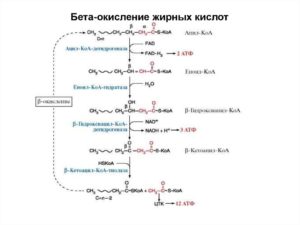
4. Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически.
В них последовательно происходит окисление (ацил-SКоА-дегидрогеназа), гидратирование (еноил-SКоА-гидратаза) и вновь окисление 3-го атома углерода (гидроксиацил-SКоА-дегидрогеназа).
В последней, трансферазной, реакции от жирной кислоты отщепляется ацетил-SКоА. К оставшейся (укороченной на два углерода) жирной кислоте присоединяется HS-КоА, и она возвращается к первой реакции. Все повторяется до тех пор, пока в последнем цикле не образуются два ацетил-SКоА.
Расчет энергетического баланса β-окисления
При расчете количества АТФ, образуемого при β-окислении жирных кислот необходимо учитывать:
- количество образуемого ацетил-SКоА – определяется обычным делением числа атомов углерода в жирной кислоте на 2.
- число циклов β-окисления. Число циклов β-окисления легко определить исходя из представления о жирной кислоте как о цепочке двухуглеродных звеньев. Число разрывов между звеньями соответствует числу циклов β-окисления. Эту же величину можно подсчитать по формуле (n/2 -1), где n – число атомов углерода в кислоте.
- число двойных связей в жирной кислоте. В первой реакции β-окисления происходит образование двойной связи при участии ФАД. Если двойная связь в жирной кислоте уже имеется, то необходимость в этой реакции отпадает и ФАДН2 не образуется. Количество недополученных ФАДН2 соответствует числу двойных связей. Остальные реакции цикла идут без изменений.
- количество энергии АТФ, потраченной на активацию (всегда соответствует двум макроэргическим связям).
Пример. Окисление пальмитиновой кислоты
- Так как имеется 16 атомов углерода, то при β-окислении образуется 8 молекул ацетил-SКоА. Последний поступает в ЦТК, при его окислении в одном обороте цикла образуется 3 молекулы НАДН (7,5 АТФ), 1 молекула ФАДН2 (1,5 АТФ) и 1 молекула ГТФ, что эквивалентно 10 молекулам АТФ.
Итак, 8 молекул ацетил-SКоА обеспечат образование 8×10=80 молекул АТФ.
- Для пальмитиновой кислоты число циклов β-окисления равно 7. В каждом цикле образуется 1 молекула ФАДН2 (1,5 АТФ) и 1 молекула НАДН (2,5 АТФ). Поступая в дыхательную цепь, в сумме они «дадут» 4 молекулы АТФ.
Таким образом, в 7 циклах образуется 7×4=28 молекул АТФ.
- Двойных связей в пальмитиновой кислоте нет.
- На активацию жирной кислоты идет 1 молекула АТФ, которая, однако, гидролизуется до АМФ, то есть тратятся 2 макроэргические связи или две АТФ.
- Таким образом, суммируя, получаем 80+28-2 =106 молекул АТФ образуется при окислении пальмитиновой кислоты.
Окисление жирных кислот: процесс, особенности и формула
Главное условие жизни любого организма — непрерывное поступление энергии, которая расходуется на различные клеточные процессы.
При этом определенная часть питательных соединений может использоваться не сразу, а преобразовываться в запасы. Роль такого резервуара выполняют жиры (липиды), состоящие из глицерина и жирных кислот.
Последние и используются клеткой в качестве топлива. При этом осуществляется окисление жирных кислот до СО2 и Н2О.
Основные сведения о жирных кислотах
Жирные кислоты представляют собой углеродные цепи различной длины (от 4 до 36 атомов), которых по химической природе относят к карбоновым кислотам. Эти цепи могут быть как разветвленными, так и не разветвленными и содержать разное количество двойных связей.
Если последние полностью отсутствуют, жирные кислоты называют насыщенными (характерно для многих липидов животного происхождения), а в противном случае — ненасыщенными. По расположению двойных связей жирные кислоты подразделяют на мононенасыщенные и полиненасыщенные.
Большинство цепей содержит четное число атомов углерода, что связано с особенностью их синтеза. Однако есть соединения с нечетным количеством звеньев. Окисление этих двух типов соединений несколько отличается.
Общая характеристика
Процесс окисления жирных кислот сложный и многостадийный. Он начинается с их проникновения в клетку и завершается в дыхательной цепи. При этом заключительные этапы фактически повторяют катаболизм углеводов (цикл Кребса, превращение энергии трансмембранного градиента в макроэргическую связь). Конечными продуктами процесса являются АТФ, CO2 и вода.
Окисление жирных кислот в клетке эукариот осуществляется в митохондриях (наиболее характерное место локализации), пероксисомах или эндоплазматическом ретикулуме.
Разновидности (типы) окисления
Существует три типа окисления жирных кислот: α, β и ω. Наиболее часто этот процесс протекает по β-механизму и локализуется в митохондриях. Омега-путь представляет собой второстепенную альтернативу β-механизму и осуществляется в эндоплазматическом ретикулуме, а альфа-механизм характерен только для одного вида жирной кислоты (фитановой).
Биохимия окисления жирных кислот в митохондриях
Для удобства процесс митохондриального катаболизма условно подразделяется на 3 этапа:
- активация и транспортировка в митохондрии;
- окисление;
- окисление образовавшегося ацетил-коэнзима А через цикл Кребса и электротранспортную цепь.
Активация представляет собой подготовительный процесс, который переводит жирные кислоты в форму, доступную для биохимических превращений, так как сами по себе эти молекулы инертны. Кроме того, без активации они не могут проникнуть в мембраны митохондрий. Эта стадия протекает у внешней мембраны митохондрий.
Собственно, окисление — ключевой этап процесса. Оно включает четыре стадии, по окончании которых жирная кислота превращается в молекулы Ацетил-КоА.
Тот же продукт образуется и при утилизации углеводов, так что дальнейшие этапы аналогичны последним стадиям аэробного гликолиза.
Образование АТФ происходит в цепи переноса электронов, где энергия электрохимического потенциала используется для образования макроэргической связи.
В процессе окисления жирной кислоты кроме Ацетил-КоА образуются также молекулы NADH и FADH2, которые тоже поступают в дыхательную цепь в качестве доноров электронов. В результате суммарный энергетический выход катаболизма липидов достаточно высок. Так, к примеру, окисление пальмитиновой кислоты по β-механизму дает 106 молекул АТФ.
Активация и перенос в митохондриальный матрикс
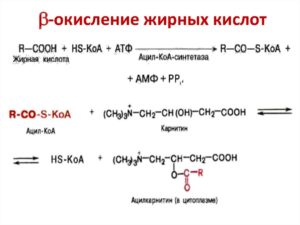
Жирные кислоты сами по себе инертны и не могут подвергаться окислению. Активация приводит их в форму, доступную для биохимических превращений. Кроме того, в неизменном виде эти молекулы не могут проникнуть в митохондрии.
Суть активации заключается в превращении жирной кислоты в ее Ацил-СоА-тиоэфир, который впоследствии и подвергается окислению. Этот процесс осуществляется специальными ферментами — тиокиназами (Ацил-СоА-синтетазами), прикрепленными к внешней мембране митохондрий. Реакция протекает в 2 этапа, сопряженных с затратой энергии двух АТФ.
Для активации необходимы три компонента:
Вначале жирная кислота взаимодействует с АТФ с образованием ациладенилата (промежуточное соединение). Тот, в свою очередь, реагирует с HS-CoA, тиоловая группа которого вытесняет АМФ, формируя тиоэфирную связь с карбоксильной группой. В результате образуется вещество ацил-CoA — производное жирной кислоты, которое и транспортируется в митохондрии.
Транспортировка в митохондрии
Эта стадия получила название трансэтирификации с карнитином. Перенос ацил-CoA в митихондриальных матрикс осуществляется через поры с участием карнитина и специальных ферментов — карнитин-ацилтрансфераз.
Для транспортировки через мембраны CoA заменяется на карнитин с образованием ацил-карнитина. Это вещество переносится в матрикс методом облегченной диффузии с участием ацил-карнитин/карнитинового переносчика.
Внутри митохондрий осуществляется реакция обратного характера, заключающаяся в отсоединении ретиналя, вновь поступающего в мембраны, и восстановлении ацил-CoA (в данном случае используется «местный» коэнзим А, а не тот, с которым была образована связь на стадии активации).
Основные реакции окисления жирных кислот по β-механизму
К самому простому типу энергетической утилизации жирных кислот относят β-окисление не имеющих двойных связей цепей, в которых количество углеродных звеньев четное. В качестве субстрата для этого процесса, как уже выше отмечалось, выступает ацил коэнзима А.
Процесс β-окисления жирных кислот состоит из 4 реакций:
- Дегидрирование — отщепление водорода от β-углеродного атома с возникновением двойной связи между звеньями цепи, находящимися в α и β-положениях (первый и второй атомы). В результате образуется еноил-CoA. Ферментом реакции является ацил-CoA-дегидрогеназа, которая действует в комплексе с кофермента ФАД (последний восстанавливается до ФАДН2).
- Гидратация — присоединение молекулы воды к еноил-CoA, в результате чего образуется L-β-гидроксиацил-CoA. Осуществляется еноил-CoA-гидратазой.
- Дегидрирование — окисление продукта предыдущей реакции НАД-зависимой дегидрогеназой с образованием β-кетоацил-коэнзима А. При этом происходит восстановление НАД до НАДН.
- Расщепление β-кетоацил-CoA до ацетил-CoA и укороченного на 2 атома углерода ацил-CoA. Реакция осуществляется под действием тиолазы. Обязательным условием является присутствие свободного HS-CoA.
Затем все снова начинается с первой реакции.
Цикличное повторение всех стадий осуществляется до тех пор, пока вся углеродная цепочка жирной кислоты не превратится в молекулы ацетил-коэнзима А.
Образование Ацетил-КоА и АТФ на примере окисления пальмитоил-CoA
В конце каждого цикла в единственном количестве образуются молекулы ацил-CoA, НАДН и ФАДН2, а цепь ацил-CoA-тиоэфира становится короче на два атома. Передавая электроны в электротранспортную цепь, ФАДН2 дает полторы молекулы АТФ, а НАДН — две. В результате из одного цикла получается 4 молекулы АТФ, не считая энерговыход ацетил-CoA.
В цепочку пальмитиновой кислоты входит 16 углеродных атомов. Это означает, что на стадии окисления должно осуществиться 7 циклов с образованием восьми ацетил-CoA, а энерговыход от НАДН и ФАДН2 в таком случае составит 28 молекул АТФ (4×7). Окисление ацетил-CoA тоже идет на образование энергии, которая запасается в результате поступления в электротранспортную цепь продуктов цикла Кребса.
Суммарный выход стадий окисления и цикла Кребса
В результате окисления ацетил-CoA получается 10 молекул АТФ. Так как катаболизм пальмитоил-CoA дает 8 ацетил-CoA, то энергитический выход будет 80 АТФ (10×8). Если сложить это с результатом окисления НАДН и ФАДН2, то получится 108 молекул (80+28). Из этого количества следует вычесть 2 АТФ, которые ушли на активацию жирной кислоты.
Итоговое уравнение реакции окисления пальмитиновой кислоты будет иметь вид: пальмитоил-CoA + 16 О2 + 108 Pi + 80 АДФ = CoA + 108 АТФ + 16 СО2 + 16 H2O.
Расчет выделения энергии
Энергетический выхлоп от катаболизма конкретной жирной кислоты зависит от количества углеродных звеньев в ее цепи. Число молекул АТФ рассчитывается по формуле:
[4(n/2 — 1) + n/2×10] — 2,где 4 — количество АТФ, образующиеся при каждом цикле за счет НАДН и ФАДН2, (n/2 — 1) — количество циклов, n/2×10 — энерговыход от окисления ацетил-CoA, а 2 — затраты на активацию.
Особенности реакций
Окисление ненасыщенных жирных кислот имеет некоторые особенности. Так, сложность окисления цепей с двойными связями заключается в том, что последние не могут подвергаться воздействию еноил-CoA-гидратазы из-за того, что находятся в цис-положении.
Эта проблема устраняется еноил-CoA-изомеразой, благодаря которой связь приобретает транс-конфигурацию. В результате молекула становится полностью идентичной продукту первой стадии бета-окисления и может подвергаться гидратации.
Участки, содержащие только одинарные связи, окисляются так же, как насыщенные кислоты.Иногда для продолжения процесса недостаточно еноил-CoA-изомеразы. Это касается цепей, в которых присутствует конфигурация цис9-цис12 (двойные связи при 9-м и 12-м атомах углерода). Здесь помехой является не только конфигурация, но и положение двойных связей в цепи. Последнее исправляется ферментом 2,4-диеноил-CoA-редуктазой.
Катаболизм жирных кислот с нечетным числом атомов
Такой тип кислот характерен для большей части липидов естественного (природного) происхождения. Это создает определенную сложность, так как каждый цикл подразумевает укорачивание на четное число звеньев.
По этой причине циклическое окисление высших жирных кислот данной группы продолжается до появления в качестве продукта 5-углеродного соединения, которое расщепляется на ацетил-CoA и пропионил-коэнзим А.
Оба соединения поступают в другой цикл из трех реакций, в результате которых образуется сукцинил-CoA. Именно он и поступает в цикл Кребса.
Особенности окисления в пероксисомах
В пероксисомах окисление жирных кислот происходит по бета-механизму, который подобен, но не идентичен митохондриальному. Он также состоит из 4-х стадий, завершающихся образованием продукта в виде ацетил-CoA, но при этом имеет несколько ключевых отличий.
Так, водород, отщепившийся на стадии дегидрирования, не восстанавливает ФАД, а переходит на кислород с образованием перикиси водорода. Последний сразу подвергается расщеплению под действием каталазы.
В результате энергия, которая могла быть использована для синтеза АТФ в дыхательной цепи, рассеивается в виде тепла.
Второе важное различие заключается в том, что некоторые ферменты пероксисом специфичны к определенным малораспространенным жирным кислотам и отсутствуют в митохондриальном матриксе.
Особенность пероксисом клеток печени заключается в том, что там отсутствует ферментный аппарат цикла Кребса. Поэтому в результате бета-окисления образуются короткоцепочечные продукты, которые для окисления транспортируются в митохондрии.
