Острый лейкоз, тромбоцитопения
Содержание
Тромбоцитопения: что это такое? Причины возникновения у взрослых, диагностика и последствия тромбоцитопении
19 апреля 202018338Европейская клиника
Тромбоцитопения — это снижение количества тромбоцитов (кровяных пластинок) в крови, в результате чего нарушается формирование кровяного тромба, возникает повышенная кровоточивость, затрудняется остановка кровотечений.
Для чего нужны тромбоциты?
Тромбоциты (кровяные пластинки) — один из трех видов форменных элементов крови (два других вида — лейкоциты и эритроциты). Их часто называют клетками крови, но на самом деле они не являются таковыми, а представляют собой отшнуровавшиеся фрагменты мегакариоцитов — особой разновидности гигантских клеток, которые находятся в красном костном мозге.
Некоторые факты о тромбоцитах:
- Два основных свойства кровяных пластинок — способность к прилипанию и склеиванию. За счет этого тромбоциты формируют пробку, которая перекрывает просвет сосуда при его повреждении.
- Кроме того, тромбоциты выделяют активные вещества, которые принимают участие в процессе свертывания крови и последующем разрушении тромба.
- Нормальные размеры кровяных пластинок — 1–4 микрометра.
- В среднем тромбоцит живет 8 суток.
Нормальное содержание тромбоцитов в крови — 150–300*109 на литр. Тромбоцитопенией называют состояние, при котором этот показатель меньше.
Как выявляют тромбоцитопению?
Для определения количества тромбоцитов назначают общий анализ крови. В зависимости от степени снижения содержания кровяных пластинок, врач может установить степень тяжести тромбоцитопении:
- умеренная тромбоцитопения — 100–180*109 на литр;
- резкая тромбоцитопения — 60–80*109 на литр;
- выраженная тромбоцитопения — 20–30*109 на литр.
Существует много причин тромбоцитопении. Их можно разделить на две большие группы: врожденные и приобретенные. Врожденные тромбоцитопении возникают в результате наследственных заболеваний, сопровождающихся нарушением кроветворения. При этом нередко изменяется не только количество, но и строение, функции кровяных пластинок.
Причины приобретенной тромбоцитопении: разведение крови (переливание растворов после большой кровопотери), скопление тромбоцитов в одном месте (например, в увеличенной селезенке), повышенное потребление кровяных пластинок при свертывании крови, разрушение в результате действия токсинов, иммунных реакций и воздействия других факторов.
Тромбоцитопения может быть самостоятельным заболеванием — это идиопатическая тромбоцитопеническая пурпура, или болезнь Верльгофа, состояние, при котором организм вырабатывает антитела против собственных тромбоцитов. В остальных случаях тромбоцитопения является лишь одним из симптомов какого-либо другого заболевания.
Причины умеренной тромбоцитопении
- Систематическое злоупотребление алкоголем, алкоголизм. Алкоголь подавляет работу красного костного мозга и вызывает дефицит фолиевой кислоты, которая нужна для кроветворения.
- Беременность. Во время беременности в организме женщины возникает много причин для развития тромбоцитопении (гормональная перестройка, разжижение крови, повышенная потребность в витаминах, аллергические реакции и пр.).
- Заболевания печени. В печени синтезируются некоторые вещества, принимающие участие в свертывании крови. Когда их выработка уменьшается, развивается повышенная кровоточивость, организм потребляет повышенное количество тромбоцитов. Кроме того, кровяные пластинки скапливаются в увеличенной селезенке.
- Применение некоторых лекарств. К тромбоцитопении могут приводить мочегонные препараты, нитроглицерин, анальгин, гепарин, витамин K, резерпин, антибиотики, цитостатики (противоопухолевые препараты).
- ДВС-синдром (диссеминированное внутрисосудистое свертывание). Это состояние, при котором в мелких сосудах происходит свертывание крови и образование большого количества микротромбов — идет интенсивное расходование тромбоцитов и снижение их уровня в крови. ДВС-синдром может развиваться при различных патологиях, например, при инфекциях и интенсивных кровотечениях.
- Системная красная волчанка и системные васкулиты. Тромбоцитопения возникает в результате аутоиммунного процесса.
- Сердечная недостаточность. Состояние, при котором сердце не может полноценно обеспечить кровоснабжение органов. Иногда при этом кровь застаивается в селезенке — она увеличивается, и в ней скапливаются тромбоциты. Также тромбоциты расходуются в результате роста тромбов в сосудах, где происходит застой крови (в частности, в венах нижних конечностей).
- Лучевая терапия. Излучение, которое уничтожает опухолевые клетки, одновременно может повредить ткань красного костного мозга, в результате чего нарушается образование эритроцитов, лейкоцитов, тромбоцитов.
Причины резкой тромбоцитопении:
- Системная красная волчанка.
- Тяжелый ДВС-синдром.
- Острые лейкозы. При лейкозах в красном костном мозге возникают злокачественные клетки, которые постепенно размножаются и вытесняют нормальную кроветворную ткань. В итоге нарушается образование эритроцитов и тромбоцитов.
- Гемолитическая болезнь новорожденного. Развивается при несовместимости крови матери и плода (по группе крови AB0, резус-фактору). В организме матери вырабатываются антитела против крови ребенка.
Причины выраженной тромбоцитопении:
- Острая лучевая болезнь. В том числе может развиваться после чрезмерных доз лучевой терапии.
- Передозировка цитостатиков. Эти препараты применяются для лечения злокачественных опухолей и некоторых других заболеваний.
- Тяжелое течение острого лейкоза.
Симптомы тромбоцитопении зависят от основного заболевания. Общие признаки:
- беспричинное появление синяков на коже;
- медленная остановка кровотечения после порезов;
- частые носовые кровотечения;
- повышенная кровоточивость слизистой оболочки рта — в слюне появляются примеси крови;
- люди с тромбоцитопенией имеют повышенный риск кровотечений во внутренних органах, кровоизлияний в головной мозг.
При появлении этих симптомов нужно посетить врача и сдать общий анализ крови. Если в нем будут обнаружены изменения, то терапевт направит вас к гематологу для дальнейшего обследования.
Умеренную и резкую тромбоцитопению зачастую можно лечить амбулаторно. Выраженная тромбоцитопения — опасное состояние, при котором больного немедленно помещают в палату интенсивной терапии.
Тактика лечения определяется основным заболеванием, которое привело к снижению количества тромбоцитов.
Записьна консультациюкруглосуточно+7 (495) 151-14-538 800 100 14 98
Тромбоцитопения при онкологических заболеваниях
Тромбоцитопения — распространенная проблема у онкологических больных. Чаще всего ее причиной становится химиотерапия. Вероятность развития тромбоцитопении зависит от типа химиопрепаратов, она наиболее высока при применении гемцитабина и препаратов платины (цисплатин, карбоплатин, оксалиплатин и др.).
Механизмы развития тромбоцитопении различаются у разных химиопрепаратов:
- Алкилирующие агенты (к которым также относят препараты платины) оказывают влияние на стволовые клетки, дающие начало не только тромбоцитам, но и эритроцитам, лейкоцитам.
- Циклофосфамид влияет на более поздние клетки-предшественники мегакариоцитов — гигантски клеток с большим ядром, от которых отшнуровываются тромбоциты.
- Бортезомиб нарушает отшнуровывание тромбоцитов от мегакариоцитов.
- Некоторые лекарственные препараты способствуют апоптозу (гибели) тромбоцитов[1].
Лучевая терапия также способна приводить к миелосупрессии — подавлению функции красного костного мозга и снижению уровня разных видов кровяных телец, в том числе тромбоцитов. Риск данного осложнения высок при облучении области таза.
При химиолучевой терапии — когда одновременно применяется лучевая терапия и химиотерапия — риск тромбоцитопении еще более высок[2].
Некоторые виды онкологических заболеваний могут сами стать причиной тромбоцитопении.
Например, при лимфоме и лейкемии опухолевые клетки поражают красный костный мозг и вытесняют его нормальную ткань. Редкие причины — поражение костей при раке простаты и молочной железы, злокачественные опухоли селезенки[3].
Когда у онкологического пациента снижается количество тромбоцитов в крови и повышается кровоточивость, врач должен учесть все возможные причины, в том числе вышеперечисленные в этой статье патологии, не связанные с онкологическим заболеванием, лучевой терапией и химиотерапией.
Как тромбоцитопения мешает лечению онкологических больных?
- При снижении уровня тромбоцитов ухудшается состояние пациента и возникают некоторые сложности с лечением:
- При снижении менее 100*109 на литр приходится с осторожностью проводить химиотерапию и лучевую терапию, так как тромбоцитопения может стать более серьезной, усиливается риск кровотечений.
- При снижении менее 50*109 на литр повышается риск серьезного кровотечения во время хирургического вмешательства.
- При снижении менее 10*109 на литр сильно повышается риск спонтанных кровотечений.
Как лечить тромбоцитопению у онкологических больных?
Стандартные методы борьбы с тромбоцитопенией при онкологических заболеваниях:
- Изменение программы терапии. Врач может изменить дозы препаратов, заменить их на другие, увеличить продолжительность перерывов между циклами химиотерапии, назначить вместо комбинации препаратов только один препарат.
- Переливание тромбоцитарной массы показано при снижении уровня тромбоцитов менее чем до 20*109/л, а если есть угроза сильного кровотечения, или пациенту предстоит курс химиотерапии — до 30*109/л и ниже.
Переливание тромбоцитарной массы приравнивается к хирургическому вмешательству. До, во время и после процедуры больного должен осмотреть врач-гемотрансфузиолог.
В ходе переливания состояние пациента контролирует медицинская сестра. Тромбоцитарную массу вводят через одноразовую стерильную систему, либо через центральный венозный катетер или инфузионную порт-систему.
Обычно переливают 1–2 дозы тромбоцитарной массы по 50–60 мл в течение 0,5–1 часа.
Как предотвратить кровотечения при тромбоцитопении: рекомендации для онкологического больного
- Пользуйтесь электрической бритвой, а не станком.
- Избегайте любых видов деятельности, во время которых вы можете получить травму.
- Используйте зубную щетку с мягкой щетиной.
- Если слизистая оболочка вашего рта кровоточит, прополощите рот несколько раз холодной водой.
- Нельзя сильно кашлять и сморкаться.
- Когда вы лежите, ваша голова должна находиться не ниже уровня сердца.
- Не используйте клизмы и ректальные свечи. Если вас беспокоят запоры, то перед применением слабительных нужно обязательно проконсультироваться с врачом.
- Нельзя принимать аспирин, ибупрофен, напроксен, препараты, снижающие свертываемость крови.
- Если началось носовое кровотечение, нужно сесть, наклонить голову вперед, поместить на нос кусочек льда или что-то холодное и зажать ноздри на 5 минут.
Записьна консультациюкруглосуточно+7 (495) 151-14-538 800 100 14 98
Список литературы:
- Managing Thrombocytopenia Associated With Cancer Chemotherapy [1]
- Low platelet count [2]
- Low Platelet Count or Thrombocytopenia [3]
Лейкоз: симптомы, причины и разновидности рака крови (лейкобластома и миелобластома), методы лечения — Здоровье сосудов
Острый миелобластный лейкоз (ОМЛ) – это злокачественный процесс в костном мозге, нарушающий функцию кроветворения. Заболевание поражает миелоидный росток. Здоровая клетка лейкоцит не созревает и выходит в кровоток в изменённом виде.
Начинается неконтролируемое деление. Лейкоциты лишены способности защищать организм от микроорганизмов и инфекций. Угнетается производство эритроцитов и тромбоцитов. Начинает развиваться анемия и тромбоцитопения.
Изменяется состав периферической крови.
Причины, провоцирующие развитие болезни, до конца не изучены. Учёные связывают ряд факторов с мутациями кроветворной системы, к примеру, наследственность, облучения или генетические аномалии.
Миелоидная лейкемия наиболее часто диагностируется у взрослых пациентов. Болезнь поражает людей после 50 лет. Пик развития рака приходится на 63 года. Миелоидному лейкозу больше подвержены пожилые мужчины. Среди молодого поколения одинаково страдают представители обоих полов.
У детей заболевание носит первичный характер. Ребёнок подвергается лейкозу при аномалиях в генетическом коде, при контакте матери с тяжёлыми отравляющими веществами (радиация, канцерогены) или если история болезней кровных родственников содержит онкологические патологии. Симптомы болезни как у взрослых.
В начале заболевания клиническая картина смазана. Постепенно больной замечает необычные изменения в состоянии. При остром течении болезни пациент отмечает симптомы самочувствия:
- Утомляемость;
- Одышка;
- Синяки и мелкие кровоподтеки;
- Кровоточивость слизистой ротовой полости;
- Инфекционные поражения организма, не поддающиеся классическому лечению и имеющие ярко выраженную симптоматику.
Для лейкозов терминальной стадии развития костный мозг лишается работоспособности, метастазы поражают органы и системы человеческого тела. Для этого характерны признаки:
- Значительное снижение веса;
- Бледность кожных покровов;
- Желудочно-кишечные и носовые кровотечения;
- Слабость;
- Боль и ломота в костях;
- Обмороки;
- Рвота с кровью;
- Чёрный стул;
- Боли в животе;
- Если поражается мочеполовая система, отмечается частичная или полная задержка мочи.
Лечением занимаются онкогематологи. Код по МКБ-10 миелолейкоза С92.
Классификация онкологической патологии
Нелимфобластный лейкоз представляет группа подвидов болезни. Для каждого вида шансы выживаемости и тактика лечения подбираются индивидуально.
Система ФАБ состоит из 9 разновидностей острого миелоидного лейкоза. Формы отличаются по типам предшественников лейкоцитов и степеням их зрелости. Клетки определяют при проведении микроскопического и цитогенетического исследования.
Клетки крови при тысячекратном увеличении
- Показатель М0 означает минимально-дифференцированную острую миелоидную лейкемию.
- М1 характеризует миелоцитарный лейкоз без созревания. В единичных бластах обнаруживаются азурофильные гранулы и палочки Ауэра.
- При М2 для лейкоза характерно созревание. Бласты преимущественно с палочками Ауэра и азурофильными гранулами.
- М3 обозначает острую форму промиелоцитарного рака крови. Клетки гипергранулированы. Палочки Ауэра присутствуют множественно.
- М4 представляет острый миеломонобластный онкологический процесс.
- При М4ео наблюдается миеломоноцитарная патология с повышенным уровнем эозинофилов в костном мозге.
- М5 определяет острый монобластный (-цитарный) лейкоз.
- М6 характеризует острые эритроидные заболевания крови.
- М7 означает мегакариобластную лейкемию.
- Подвид М8 представляет базофильное малокровие.
Исследования при лейкозах
Диагностика лейкозов заключается в изучении состава крови и костного мозга. Точный диагноз определяется только после забора биоптата из бедра или ребра для дальнейшего исследования.
Вначале проводят анализ крови. Наблюдаются отклонения в показателях лейкоцитов. Результат может быть представлен от 0,1*109/л до 10*100*109/л. Небольшие нарушения свидетельствуют о монобластной лейкемии или о эритромиелозе. В сыворотке крови не обнаруживаются базофилы. Скорость оседания эритроцитов (СОЭ) увеличена.
Эритроциты представлены низкими показателями. В крови преобладают бласты и клетки зернистого ряда. Отмечаются созревшие моноциты. Снижен уровень гемоглобина.
- С помощью биохимического исследования определяется количество общего белка, билирубина, альбумина, мочевины и креатинина.
- Для острого лейкоза первой фазы анализ крови может иметь следующую картину:
- Показатели общего белка – 78 ммоль/л.
- Общего билирубина – 14-17 ммоль/л.
- Прямого билирубина – 3,5-4,5 ммоль/л.
- Уровень креатинина – 108 мкмоль/л.
Благодаря цитохимическим показателям изучается активность ферментов, состав крови, костного мозга и других тканей организма.
Иммунологический тест является комплексным исследованием нарушений в работе иммунитета. Для анализа используют венозную кровь. Определяются иммунные клетки, их функции, активность и способность уничтожать бактерии.
Для выявления метастазов в миокарде используют электрокардиограмму и эхокардиографию.
Ультразвуковая диагностика выявляет отклонения во внутренних органах человека. Метод позволяет изучить печень, органы желудочно-кишечного тракта и мочеполовой системы, лимфатические узлы.
Вариант глобальной диагностики всех органов и систем представлен проведением магнитно-резонансной и компьютерной томографии. Методы послойно сканируют участки тела. Выявляются даже незначительные изменения в тканях.
Лечебная тактика
Лечение проводится в стационарных условиях, где снижается контакт с окружающим миром. Клинические рекомендации заключаются в проведении химиотерапии. Онкогематолог выбирает соответствующий протокол для каждого случая. При диагнозе «Острый миелобластный лейкоз» врачи подбирают комбинацию препаратов. Интенсивная химиотерапия помогает вылечиться и войти в стойкую ремиссию.
Проведение процедуры химиотерапии
На первом этапе лечения назначенные препараты без разбора убивают здоровые и раковые клетки. Развиваются побочные явления:
- Тошнота;
- Рвота;
- Вялость;
- Язвенные поражения полости рта;
- Назальные кровотечения;
- Организм больного подвержен присоединению опасных инфекций.
На втором этапе назначают несколько курсов цитостатиков. Для уничтожения рака важен приём высокой дозы цитозин-арабинозида. Препарат препятствует созданию частиц, переносящих наследственную информацию. При печёночной и почечной недостаточностях или угнетении костного мозга приём препарата запрещен.
- Для угнетения функций костного мозга и борьбы с опухолевыми клетками назначают Идарубицин.
- Митоксантрон подавляет иммунитет и уничтожает опухоли.
- Для достижения максимальной эффективности используют протоколы с тремя блоками постремиссионной химии.
- Прогноз жизни на фоне химиопрепаратов значительно улучшается.
При поражении органов центральной нервной системы рекомендована лучевая терапия. Ионизирующее излучение вступает в реакцию с аномальными клетками, нарушает их структуру и провоцирует гибель.
Среди людей ходят истории об исцелении рака крови с помощью народной медицины. Однако ни один метод или препарат не показал 100% эффективности.
Отказываясь от врачебного вмешательства, больной позволяет лейкозу стремительно развиваться и нарушать работу жизненно важных органов! Лечением может заниматься только квалифицированный врач онколог после проведения тщательной диагностики. Нетрадиционные методы обычно только усугубляют течение болезни.Полное выздоровление наступает после пересадки костного мозга. Метод имеет нюансы и последствия:
- До начала проведения операции (вливание донорского материала через установленный в артерию катетер) больному уничтожают костный мозг с помощью ударных доз химиотерапии.
- При отсутствии иммунитета любые инфекции и болезни, к примеру, ОРЗ или царапина могут привести к летальному исходу.
- Трансплантируемый материал может не взаимодействовать с организмом пациента:
- В первом случае чужой костный мозг организм человека воспринимает за чужеродный и отторгает его. Нарушается работа всех органов. Иммунные клетки убивают все на своем пути. Однако при этом окончательно уничтожаются раковые клетки без возможности развиться снова. Иммуносупрессивная терапия помогает наладить нормальный кроветворный процесс.
- Организм пациента отвергает введенные стволовые клетки. Иммунитет не формируется. Выработка кровяных телец не начинается.
- При введении биоматериала развивается аллергия или анафилактический шок.
- Половина пациентов умирают в первый месяц после операции.
Подходящий костный мозг трудно достать. Лучшими донорами являются однояйцевые близнецы, родные братья и сестры. Материал родителей подходит очень редко.
Стволовые клетки могут быть взяты у самого пациента в период ремиссии или у постороннего человека.
Прогнозы на жизнь
Шанс на полное выздоровление имеют 90% пациентов до 60 лет. Пожилой организм не справляется с раком и нагрузками при химиотерапии. Пациент до конца жизни использует паллиативное лечение. Пятилетняя выживаемость пожилых людей составляет 12-25%.
Шанс на выживаемость снижается при наличии сопутствующих онкологических проблем или заболеваний генетического типа (болезнь Дауна). Рецидив развивается в любой момент. Вторичное заболевание не поддаётся лечению.
Если больной в течение 5 лет не отмечал симптомы лейкоза и не обращался за помощью, его снимают с онкологического учёта и считают здоровым.
Специфическая профилактика лейкемии отсутствует.
ОМЛ: симптомы, можно ли вылечиться и продолжительность жизни
Острый миелобластный лейкоз
В повседневной жизни нам часто приходится слышать о раковых заболеваниях, в частности об онкологических заболеваниях крови.
Одним из таковых является острый миелобластный лейкоз (ОМЛ) или острая лейкемия, который в быту именуется как рак крови или белокровие. Сложность ОМЛ, во-первых, в том, что на начальных этапах явных признаков болезни не наблюдается.
Во-вторых, сам процесс лечения очень сложен, как с медицинской точки зрения, так и в эмоциональном плане для пациентов.
Итак, разберемся, что это такое — острый миелобластный лейкоз, какова причина, как лечат, какие прогнозы для излечения, можно ли вылечиться и от чего это зависит.
ОМЛ: определение
Острый миелобластный лейкоз – опухолевое повреждение миелоидного ростка клеток крови. Это повреждение подавляет здоровые элементы клетки, при этом же не может осуществлять их функцию. Острым он является потому, что данное заболевание быстро прогрессирует из-за активной выработки большого количества незрелых видов лейкоцитов.
Заболевание имеет еще несколько подвидов, таких как:
- Миеломонабластный лейкоз;
- Миеломоноцитарный;
- Монобластный лейкоз (моноцитарный тип);
- Мегокарнобластный;
- Эритробластный.
Этот список неокончательный, и некоторые из них относительно недавно обнаружены учеными. Также существуют и другие виды заболеваний костного мозга, таких как, миелоидный лейкоз (миелолейкоз). Им больше страдают взрослые и пожилые люди, нежели дети.
Причины ОМЛ
Вескую причину, из-за чего возникает эта болезнь, ученые не установили. Есть только несколько факторов, возможно, увеличивающие вероятность заболевания. Рассмотрим их:
- Химический канцерогенез. Причиной является химические соединения пестицидного и гербицидного ряда воздействующие на клетки костного мозга. Отмечено, что в период от 3 до 5 лет после химотерапии, вероятность образования одного из разновидностей лейкоза кратно увеличивается. Опасность могут представлять алкирующие вещества, а также антрациклины и эпиподофилотоксины. Вопрос о том, влияет ли бензол и другие ароматические растворы на образование ОМЛ, пока вызывает споры среди специалистов. По крайней мере, данные вещества не являются основным фактором развития данного заболевания, а скорее добавочным. Такие тяжелые металлы как свинец, железо, стронций, негативно влияют на функцию костного мозга. Под воздействием токсинов, вырабатываемых ими, процесс кроветворения нарушается. Особенно на стадии созревания лейкоцитов. Миелобласты – предшественники лейкоцитарного ряда. При ОМЛ количество вырабатываемых лейкоцитов увеличивается в несколько раз. Это явление носит название бластный криз.Ионизирующее излучение
- Ионизирующее излучение. Радиация является толчком к развитию болезни. Ярким примером могут служить результат сброса ядерного оружия на Хиросиму и Нагасаки. Все мы знаем, к каким последствиям привела эта страшная трагедия. Именно тогда заболеваемость острым миелобластным лейкозом выросла. Также ОМЛ зачастую встречается у рентгенологов, которые пренебрегали средствами защиты.
- Биологический канцерогенез. Причиной является злокачественная трансформация клеток миелоиодного ростка. Если кто-либо в роду перенес данное заболевание, то с большей вероятностью оно передастся следующему поколению. Данный фактор говорит о генетической предрасположенности к миелобластному лейкозу. Кроме этого вероятность ОМЛ у людей, с врожденными отклонениями, такими как, синдром Дауна, повышена в 10-20 раз.
Острый лимфобластный лейкоз
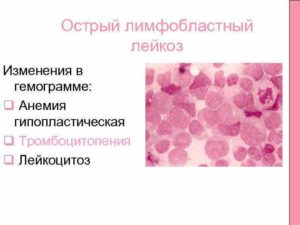
Острый лимфобластный лейкоз – самое частое детское онкологическое заболевание и составляет примерно 25 % от всех онкозаболеваний в педиатрии. Это злокачественное новообразование из группы клеток-предшественников лимфоцитов (лимфобластов).
Острый лимфобластный лейкоз преимущественно детское заболевание. У взрослых он тоже встречается, но намного реже. Сначала страдающие этим заболеванием жалуются на общее недомогание, утомляемость, головокружения, высокую температуру. Возможно даже предобморочное состояние. Это анемический синдром, он возникает из-за угнетения синтеза эритроцитов в красном костном мозге.
На коже и слизистых у страдающих лейкозом появляются кровоизлияния. Это могут быть как петехии (мелкие красные точки), так и массивные кровоизлияния. Так проявляется геморрагический синдром, возникающий из-за снижения содержания тромбоцитов в крови.
https://www.youtube.com/watch?v=9L2fgTdUUSg
Также может увеличиваться печень, селезенка и лимфатические узлы. Это происходит из-за того, что бластные клетки инфильтруют органы и ткани. Так проявляется гиперпластический синдром.
Все это сопровождается болевым синдромом – болью в костях и суставах.
Кроме того, страдающие острым лейкозом подвержены инфекционным заболеваниям, чаще всего ангинам, бронхитам и пневмониям, так как снижается иммунитет и, соответственно, сопротивляемость организма различным инфекциям.
Если же на коже обнаружены выпуклые розовые или коричневые пятна, более плотные, чем кожа (лейкемиды), значит, заболевание зашло уже очень далеко.
Описание
Патологический процесс происходит в костном мозге. Именно там в норме из бластных клеток созревают элементы крови, в том числе и лимфоциты.
Лимфоциты – главные клетки иммунной системы человека. Они обеспечивают выработку антител, клеточный иммунитет, регулируют деятельность других клеток. В норме у здорового человека 1000-3000 кл/мкл, но основная их часть (98 %) находится в тканях, а в крови циркулирует всего 2 %. В процессе созревания лимфоциты проходят несколько стадий, первая из которых – лимфобласты.
Созревают клетки крови в красном костном мозге. Но иногда по каким-то причинам клетки крови не могут правильно развиваться или вообще утрачивают способность к созреванию, как при остром лимфобластном лейкозе. В зависимости от пораженных клеток, В-лимфоцитов или Т-лимфоцитов, заболевание делится на В-линейный (85 %) и Т-линейный (15 %) лимфолейкоз.
Лейкозные бластные клетки качественно отличаются от обычных.Причин для возникновения острого лимфобластного лейкоза у детей много, но основные факторы риска – это:
- случаи онкозаболеваний у родственников;
- возраст матери при беременности;
- вес ребенка при рождении более 4 кг;
- инфекционные заболевания в младенческом возрасте;
- воздействие различных канцерогенов (лучевая терапия, курение) на организм матери во время беременности;
- воздействие вирусных мутагенов на организм матери во время беременности
- хромосомные аномалии.
У взрослых острый лимфобластный лейкоз протекает тяжелее, чем у детей. А к факторам риска относятся:
- воздействие радиационного излучения;
- возраст старше 70 лет;
- генетические нарушения.
Существует несколько стадий лейкоза.
- начальная стадия острого лейкоза чаще всего диагностируется у пациентов с предшествующей анемией.
- на развернутой стадии присутствуют основные клинические и гематологические проявления заболевания.
- ремиссия может быть полной и неполной. Полной клинико-гематологическая ремиссия считается, если в течение одного месяца нет симптомов заболевания, в костном мозге определяется не более 5 % бластных клеток и не более 30 % лейкоцитов, а в крови их нет вообще. При неполной клинико-гематологической ремиссии в пунктате красного костного мозга обнаруживается не более 20 % бластных клеток, при этом симптомов заболевания нет и гемограмма в норме.
- рецидив.
- терминальная стадия. Последняя стадия заболевания, при которой не помогает цитостатическая терапия, кроветворение угнетено.
Диагностика
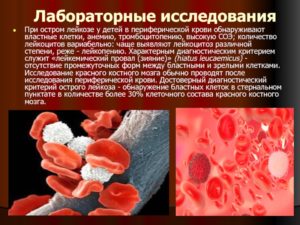
Так как симптомы, особенно в начале болезни, характерны для многих заболеваний, необходимо провести тщательное обследование. В первую очередь делают анализ крови. При остром миелобластном лейкозе очень характерная картина крови.
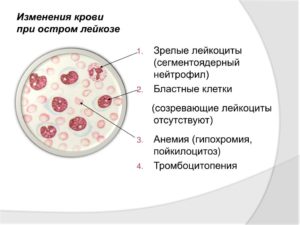
В 98 % случаев выявляют бластные клетки, а кроме того, обнаруживают «лейкемический провал» — наличие в крови только бластов и зрелых клеток без промежуточных стадий. Также характерны анемия и тромбоцитопения.
В 20 % случаев в мазке обнаруживается лейкопения, в 50 % — лейкоцитоз.
Но для точной диагностики необходимо исследование красного костного мозга. Чтобы материала хватило на исследование, пункцию берут из двух точек.
При исследовании на миелограмме обнаруживается гиперклеточный костный мозг с суженными ростками нормального костного мозга и бластные клетки.
Причем, для постановки диагноза «острый лимфобластный лейкоз» достаточно, чтобы бластными клетками было замещено 25 % костного мозга.
Еще одно обязательное исследование – пункция спинного мозга. Это нужно, чтобы определить, есть ли лейкемическое поражение ЦНС (нейролейкемия).
УЗИ брюшной полости и рентгенография грудной клетки показывают степень инфильтрации различных органов бластными клетками.
Кроме всего прочего пациента проверяют на носительство Филадельфийской хромосомы. Это 22-я хромосома, в которую встраивается определенный участок 9-й хромосомы.
В результате этой мутации клетка нечувствительна к факторам роста и избыточно пролиферирует (делится).Вообще, эта мутация характерна для острого миелобластного лейкоза, но иногда она встречается у пациентов с лимфобластным лейкозом и осложняет течение заболевания.
Перед началом химиотерапии делают ЭКГ и ЭхоКГ.
Лечение
Лечение нужно начинать сразу же после постановки диагноза, так как развивается острый лимфобластный лейкоз очень быстро. Проводится лечение в специализированных гематоонкологических стационарах.
Основной метод лечения лимфолейкоза – химиотерапия. Она состоит из нескольких этапов и направлена на достижение и закрепление ремиссии. Она направлена на максимальное уничтожение бластных клеток в костном мозге и крови.
Параллельно проводят сопроводительную терапию, направленную на борьбу с инфекциями, устранение побочных эффектов от химиотерапии, устранение симптомов интоксикации. При тяжелой анемии и тромбоцитопении проводят переливание элементов крови.
Лечить острый лимфобластный лейкоз можно и облучением, но этот метод менее популярен, чем химиотерапия. Обычно облучение применяют перед трансплантацией костного мозга.
Еще один метод лечения лимфолейкоза – трансплантация стволовых клеток или костного мозга. Этот метод обычно применяется у пациентов, течение болезни которых осложнено наличием филадельфийской хромосомы.
При любом методе лечения очень важно не допускать попадания инфекции в организм, так как иммунитет у страдающих лимфолейкозом очень слабый.
У детей острый лимфобластный лейкоз лечится гораздо лучше, чем у взрослых. Так, на сегодня около 70 % детей, страдающих острым лимфобластным лейкозом, имеют как минимум 5-летнюю ремиссию заболевания. У взрослых длительный период ремиссии наступает в 15-25 % случаев.
© Доктор Питер
Лейкозы
Острый лейкоз, или лейкемия (англ. – «leukemia») – это злокачественное заболевание, берущее свое начало в костном мозге. Костный мозг – это гемопоэтическая ткань (ткань, где клетки крови проходят ранние этапы развития), находящаяся у взрослых в плоских костях скелета (тазовые кости, грудина, ребра, позвонки, череп).
В нормальном костномозговом кроветворении бласты (или клетки-предшественницы, или стволовые клетки) проходят этапы созревания и размножения в более зрелые клетки, формируя два различных ростка крови – лимфоидный (В-и Т-лимфоциты) и миелоидный (нейтрофилы — гранулоциты, эритроциты, тромбоциты).
В связи с генетическими поломками созревание бластов в зрелые клетки крови может нарушиться, вследствие чего в костном мозге накапливаются бласты, а в периферической крови количество нормальных клеток крови уменьшается, что приводит к осложнениям, вместо форменных элементов крови также появляются бластные клетки.
Кроме того, эти патологические бласты могут выходить за пределы костного мозга и формировать внекостномозговые очаги поражения (например, большой объем в грудной клетке, увеличенная селезенка или лимфатические узлы, проникновение бластов в спинномозговую жидкость, а также накапливаться в других органах и тканях).
Таким образом, субстратом острого лейкоза являются опухолевые клетки, называемыми бластами. Однако стоит помнить, что врач в своем разговоре может использовать слово бласт, имея в виду стволовую клетку-предшественницу.
Острые лейкозы делятся на лимфоидные и миелоидные в зависимости от исходной пораженной клетки-бласта.
Также лейкозы бывают и хроническими, не только острыми.
Необходимо отметить, что острый лейкоз никогда не переходит в хронический, а хронический никогда не обостряется — таким образом, термины «острый» и «хронический» используются только из-за удобства; значение этих терминов в гематологии отличается от значения в других медицинских дисциплинах.Исключением является лишь хронический миелобластный лейкоз, острая или терминальная фаза которого характеризуется развитием бластного криза — появлением в крови и костном мозге >20% бластных клеток, то есть развитием острого миелобластного (или лимфобластного) лейкоза.
Острый лейкоз – это заболевание, которое развивается стремительно, поскольку клетки в костном мозге делятся очень быстро.
Следовательно, достаточно быстро появляются и симптомы болезни, но они настолько неспецифичные, что, как правило, проходит очень много времени, прежде чем пациент обратится в профильное медицинское учреждение.
Симптомы острых лейкозов не отличаются в зависимости от их варианта, миелоидный или лимфоидный, и возникают вследствие неэффективного кроветворения. Среди них можно выделить основные:
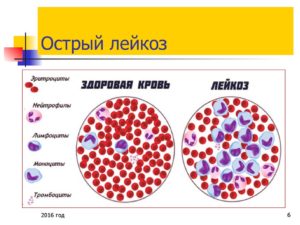
- Анемия, или снижение уровня гемоглобина, которое проявляется анемическим синдромом: головная боль, головокружение, «мушки перед глазами», сильная общая слабость, бледность кожи и слизистых оболочек, одышка при физической нагрузке и в покое при быстром разговоре, например;
- Тромбоцитопения, или снижение числа тромбоцитов, проявляющееся так называемым геморрагическим синдромом, при котором появляются гематомы («синяки») на руках, ногах, теле порой даже без удара. Может появиться петехиальная сыпь – мелкоточечная красная сыпь, похожая на мелкие «сосудики», как правило, на ногах, руках и в местах наибольшего трения (в паховых, подмышечных складках, складках под молочными железами), а также на слизистой оболочке полости рта, как после прикусывания. Кроме того, низкое количество тромбоцитов может проявляться кровотечениями из различных источников – нос, дёсны, желудочно-кишечный тракт, может появляться кровь в моче и кале, у женщин – кровотечение из половых путей;
- Нейтропения, или снижение числа нейтрофилов (гранулоцитов) – клеток, отвечающих за ответ на бактериальные и грибковые инфекции. Поскольку эти «защитные» клетки снижаются, организм подвержен различным инфекциям, поэтому зачастую появляются воспаления различных локализаций: слизистой оболочки полости рта – мукозиты, гингивиты; легких – бронхиты, пневмонии; кожи – флегмоны, абсцессы; мочевыводящих путей, перианальной области, глаз и других;
- Общие симптомы: повышение температуры тела, даже без очага инфекции; потливость, преимущественно по ночам; общая слабость, усталость, быстрая утомляемость; потеря веса без изменения питания.
Подходы к лечению острого лимфоидного и миелоидного лейкозов принципиально различаются, несмотря на применение химиотерапии и трансплантации костного мозга при обоих вариантах. Поэтому для выбора тактики лечения основным является установить разновидность острого лейкоза. Диагноз острого лейкоза устанавливается на основании изучения клеток костного мозга.
Для этого выполняется пункция костного мозга и трепанобиопсия подвздошной кости. В отделении химиотерапии гемобластозов эта манипуляция выполняется как стационарным, так и амбулаторным пациентам и в среднем занимает 10 минут.
Для установления варианта острого лейкоза проводится комплексное исследование бластных клеток костного мозга: морфологическое, цитохимическое, иммунофенотипическое, цитогенетическое и молекулярно-генетическое, а также при необходимости гистологическое и иммуногистохимическое исследования трепанобиоптата костного мозга.
Необходимо полноценное обследование больного в дебюте заболевания, а также при каждом рецидиве для того, чтобы определить группу риска и выбрать адекватный план лечения, а также возможное использование таргетных (целенонаправленных) препаратов.
На начальном этапе лечения (если возможно) или при достижении ремиссии всем пациентам с диагнозом острого лейкоза проводится HLA- типирование и типирование по системе KIR периферической крови самого пациента и его сиблингов (родных братьев и сестер) как потенциальных доноров костного мозга. Типирование по двум системам наиболее полно характеризует совместимость донора и больного, а также определяет возможные исходы аллогенной трансплантации костного мозга. Это необходимо для того, чтобы врач имел полную информацию о терапевтических возможностях для каждого пациента.
Лечение пациентов острыми лейкозами проводится в соответствии с национальными и международными рекомендациями, используются современные системы стратификации риска, а также имеет место персонифицированный (индивидуализированный) подход.
Принципы терапии острого лимфобластного лейкоза основываются на непрерывном цитостатическом воздействии, а не циклическом. В среднем стандартное лечение занимает 2,5 – 3 года. В настоящее время в отделении проводится набор пациентов моложе 55 лет для лечения по всероссийской программе «ОЛЛ-2016».
Особенностью этого протокола является рандомизация (случайное распределение) пациентов с Т-линейным иммуновариантом ОЛЛ на аутоТКМ или без неё. Место аутоТКМ в лечении острого Т-лимфобластного лейкоза/лимфомы до настоящего времени не определено.
Больным из высокой группы риска исходно планируется трансплантация костного мозга от полностью или частично совместимого родственного донора, если таковой есть.
Больных острым миелоидным лейкозом в дебюте заболевания сразу относят к благоприятной, промежуточной или неблагоприятной группе прогноза, что основывается от варианта острого миелоидного лейкоза и в зависимости от его молекулярно-цитогенетических свойств.Пациентам в низкой группе риска показана стандартная курсовая химиотерапия, которая обычно проводится в течение 8-12 месяцев.
Больным в группе среднего риска при достижении ремиссии желательно выполнить аллогенную трансплантацию костного мозга, если есть полностью или частично совместимый родственный донор.
Пациентам в группе высокого риска основной целью лечения является выполнение аллогенной трансплантации костного мозга в ранние сроки при достижении ремиссии. Если у больного нет родственного донора, то его направляют в центры, где имеется возможность провести трансплантацию костного мозга от полностью или частично совместимого неродственного донора.
Вне зависимости от варианта лейкоза пациенту предстоит длительное и тяжелое лечение с включением, помимо цитостатиков, противомикробных препаратов и переливание компонентов крови, порой сопровождающееся значимыми для качества жизни осложнениями. Поэтому также как и первичное обследование важен первичный контакт с лечащим врачом для того, чтобы пациент правильно понимал необходимость и целесообразность выбранного варианта лечения.
Хронический лимфолейкоз
Хронический лимфолейкоз (ХЛЛ, лимфома из малых лимфоцитов или лимфоцитарная лимфома) – клональное лимфопролиферативное заболевание, характеризующееся пролиферацией и увеличением в периферической крови количества зрелых лимфоцитов на фоне лимфоцитарной инфильтрации костного мозга, лимфатических узлов, селезёнки и других органов.
Заболевание развивается, когда происходит нарушение роста и развитие лимфоцитов. Лимфоциты играют важную роль в иммунной системе, они синтезируют антитела, которые нейтрализуют различные бактерии и вирусы.
Термин «хронический» отражает степень дифференцировки опухолевых клеток, а не стадию процесса. Этиология хронического лимфолейкоза до конца не ясна.
Большую роль в развитии заболевания играют наследственная предрасположенность, хотя типичные хромосомные мутации не выявлены, но наследственный характер прослеживается в каждом 10-м случае.
Благодаря успехам в понимании биологии хронического лимфолейкоза и разработке детального молекулярно-цитогенетического тестирования, мы можем оказывать нашим пациентам индивидуализированную помощь.В некоторых случаях, лечение не требуется и тогда пациентам будет предоставлено тщательное динамическое наблюдение.
При другом течение болезни наша команда сможет предоставить Вам инновационные методы терапии, включая новые таргетные препараты.
Тромбоцитопения
Тромбоцитопения
Тромбоцитопения представляет собой состояние, характеризующееся понижением количества тромбоцитов (красных клеток крови) до 140 000/мкл и ниже и сопровождающееся повышенной кровоточивостью.
Тромбоциты участвуют в процессе купирования локальных воспалительных явлений, а также играют основную роль в остановке кровотечений. При уменьшении количества таких клеток в крови возникает большое количество точечных кровоизлияний в организме .
Основной причиной патологического процесса считается метаплазия мегакариоцитарной ветви в отделе костного мозга, продуцирующем тромбоциты. Метаплазия обусловлена несколькими патологическими состояниями:
- Метастатические новообразования в костном мозге,
- Онкология кроветворной системы (лейкоз, лимфома, миелома),
- Миелофиброз,
- Саркоидоз.
При раковых опухолях причины снижения тромбоцитов следующие:
- Угнетение функции костного мозга токсическими веществами,
- Увеличение селезенки,
- Железодефицитная анемия тяжелой формы,
- Выталкивание аномальными клетками мегакариоцитарного отростка,
- При иммунной тромбоцитопении продуцируются аутоантитела, уничтожающие тромбоциты.
Симптомы тромбоцитопении
Независимо от первопричин уменьшения количества красных кровяных клеток, тромбоцитопения имеет следующие неспецифичные симптомы:
- Кровоточивость десен,
- Частые внутрикожные кровоизлияния,
- Кровотечения из носа,
- Кровоизлияния в органах ЖКТ,
- Внутренние кровотечения.
Перечисленные признаки также появляются при других болезнях, например заболевании сосудов, вызванном авитаминозом, тромбоцитопатии, обусловленной продуцированием дегенеративных тромбоцитов и т.д.
При появлении признаков патологического процесса необходимо обратиться к врачу для тщательного обследования и постановки диагноза.
Диагностика тромбоцитопении
Как правило, патологические изменения, обусловленные тромбоцитопенией, характеризуются яркой симптоматикой, поэтому для опытных врачей диагностика не представляет сложности. После физического осмотра и опроса пациента врач назначает ряд диагностических процедур, позволяющих подтвердить или опровергнуть диагноз.
К дополнительным исследованиям относятся следующие процедуры:
- Пункция костного мозга,
- Анализ крови – позволяет определить количество составляющих элементов крови,
- Иммунологическое исследование.
Лечение тромбоцитопении у детей
У детей с тромбоцитопенией прогноз благоприятный – выздоровление наступает самостоятельно в течение полугода. Поэтому если угроза тяжелого внутреннего кровоизлияния отсутствует, рекомендовано наблюдение за состоянием ребенка.
При геморрагическом синдроме, высыпаниях на слизистых оболочках или лице, кровотечениях или стремительном уменьшении количества красных клеток крови назначается терапия стероидными препаратами, например, преднизолоном. Положительный терапевтический эффект обычно заметен в первые дни лечения; спустя 7-10 дней высыпания полностью исчезают.
Лечение тромбоцитопении у взрослых
Самостоятельное выздоровление взрослых с тромбоцитопенией отмечается очень редко. При количестве тромбоцитов, превышающем 50 000/мкл, лечение обычно не проводится. При более низких показателях (30 000 – 50 000/мкл) и высокой вероятности кровотечений, обусловленных, например, язвой желудка и 12-типерстной кишки, а также высокой гипертензией, назначается медикаментозная терапия.
При объеме красных клеток менее 30 000/мкл требуется незамедлительное лечение. В случае уменьшении тромбоцитов до 20 000/мкл и ниже необходима госпитализация пациента.
Лечение включает назначение преднизолона в течение месяца. Критерии успешности терапии следующие:
- Полное выздоровление – количество красных клеток крови после окончания курса лечения составляет около 150 000/мкл,
- Частичное выздоровление – количество красных клеток увеличивается до 50 000/мкл,
- Отсутствие эффекта – признаки патологии сохраняются, при этом количество красных клеток крови увеличивается не более чем на 15 000/мкл.
При отсутствии желаемых результатов терапии назначается иммунотерапевтическое лечение, предполагающее введение в организм иммуноглобулинов и высоких доз стероидных препаратов, действие которых направлено на угнетение выработки антител. При отсутствии терапевтического эффекта в течение полугода проводится спленэктомия, в результате чего количество кровяных клеток поднимается до нормального уровня.
Терапия вторичной тромбоцитопении направлена на устранение первичной болезни и устранение возможных осложнений. При критическом уменьшении уровня тромбоцитов проводится переливание крови и назначается преднизолон.
Острый лейкоз: причины, симптомы, лечение болезни крови
Острая лейкемия – это агрессивная форма рака крови. На прогнозы по выздоровлению пациента при этом заболевании влияет, в первую очередь, своевременная диагностика и правильно выбранный курс лечения. Мы расскажем о симптомах, эффективных методах диагностики и терапии лейкоза.
Причины развития лейкоза
Острый лейкоз крови (белокровие) развивается вследствие мутации кроветворной клетки-предшественницы лейкоцитов, которая быстро пролиферирует.
Опухолевые клоны вытесняют нормальные гемопоэтические клетки и костный мозг лишается возможности продуцировать кровяные тельца в нужном объёме.
После выхода незрелых мутировавших клеток в кровоток они накапливаются в периферической крови и вызывают лейкемическую инфильтрацию внутренних органов.
Все атипичные клетки имеют одни и те же цитохимические и морфологические характеристики, что подтверждает их раковое происхождение и статус клонов одного и того же бласта.
Точные причины острого лейкоза не выяснены, однако специалисты, которые занимаются заболеваниями кроветворной системы (гематологи) выявили ряд факторов риска. К ним относят:
- наследственная предрасположенность (диагностированные случаи лейкоза у близких родственников);
- некоторые хромосомные патологии (синдром Дауна, болезнь Клайнфельтера и др.);
- вирусные инфекции (существует риск аномального иммунного ответа на возбудитель инфекции, преимущественно гриппа);
- гематологические болезни (миелодисплазия, некоторые виды анемии);
- воздействие радиации и химических канцерогенов (бензола, толуола, соединений мышьяка);
- цитостатическая терапия по поводу других видов рака (лимфом, множественных миелом, лимфогранулематоза).
В большинстве случаев острого лейкоза имеют место сразу несколько причин возникновения мутации клеток.
Например, считается, что развитие лимфобластной лейкемии у детей обусловлено действием неблагоприятных экологических факторов на организм матери и ребёнка, иммунным ответом на вирусные инфекции и наследственной предрасположенностью.
При некоторых видах заболевания, ассоциированных с мутацией MLL-гена, патологическое изменение бластов завершается ещё до рождения ребёнка.
Классификация острых лейкемий
Острую форму заболевания диагностируют в 97% всех клинических случаев лейкоза. Переход острой лейкемии в хроническую форму невозможен, поэтому разделение по протеканию болезни не соответствует аналогичной классификации в другой области медицины.
«Обострение» хронического лейкоза возможно при продолжительном действии канцерогенных факторов, спровоцировавших развитие заболевания. В этом случае на фоне протекания хронического белокровия наблюдаются симптомы острого лейкоза.
Морфологически лейкемии делятся на лимфобластные (возникающие из клеток-предшественниц лимфоцитов) и нелимфобластные. Вторая группа объединяет все остальные формы заболевания.
Лимфобластные лейкемии, в свою очередь, классифицируют по типу лимфоцитов, которые дали начало процессу. Выделяют пре-пре-В-лимфобластную, пре-В-лимфобластную, В-лимфобластную и Т-лимфобластную форму болезни.
Острые лейкозы нелимфобластного типа подразделяются на миелобластные (развиваются из пре-гранулоцитов), моно- и миеломонобластные (характеризуются аномальной пролиферацией монобластов), мегакариобластные и эритробластные (развиваются из клеток-предшественниц тромбоцитов и эритроцитов соответственно).
Помимо лимфобластного и нелимфобластного лейкозов выделяют недифференцированное белокровие. Такая форма болезни очень агрессивна, т.к. деление опухолевых клеток без определённых морфологических признаков происходит активнее, чем на более зрелых стадиях их развития.
Острый лейкоз у взрослых обычно относится к нелимфобластному типу. В большинстве случаев у них фиксируют миелобластную форму лейкемии. В зоне риска в основном находятся пожилые пациенты и те, кто постоянно контактирует с химическими канцерогенами и ионизирующим излучением.
Острый лимфобластный лейкоз характерен для детей. Пик заболеваемости приходится на 2-5 лет, причём мальчики болеют чаще девочек. Также лейкемию могут диагностировать у подростков – небольшой всплеск на графике зависимости заболеваемости от возраста наблюдается в районе 10-13 лет.Точное определение морфологических характеристик клеток важно для подбора правильной тактики лечения. Степень дифференцированности опухолевых клонов определяет агрессивность рака и влияет на прогноз выживаемости пациента.
Стадии заболевания
Течение лейкемии принято подразделять на пять стадий или этапов:
- начальную стадию;
- развёрнутую стадию;
- полную или неполную ремиссию;
- рецидив;
- терминальную стадию.
