Полиморфизмы генов системы свертываемости крови
Содержание
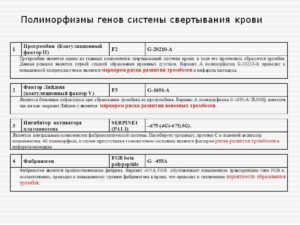
Плазменные факторы системы свертывания крови. Исследование полиморфизмов в генах: F2 (20210, G>A), F5 (R534Q, G>A), F7 (R353Q, G>A), FGB (455, G>A), SERPINE1/PAI-1 (-675, 5G>4G)
array(20) { [«catalog_code»]=> string(6) «180014» [«name»]=> string(248) «Плазменные факторы системы свертывания крови.
Исследование полиморфизмов в генах: F2 (20210, G>A), F5 (R534Q, G>A), F7 (R353Q, G>A), FGB (455, G>A), SERPINE1/PAI-1 (-675, 5G>4G)» [«period»]=> string(1) «5» [«period_max»]=> string(2) «12» [«period_unit_name»]=> string(6) «к.д.
» [«cito_period»]=> NULL [«cito_period_max»]=> NULL [«cito_period_unit_name»]=> NULL [«group_id»]=> string(6) «392581» [«id»]=> string(4) «3069» [«url»]=> string(53) «plazmennyje-faktory-sistemy-svertyvanija-krovi_180014» [«podgotoa»]=> string(136) «
Не менее 3 часов после последнего приема пищи. Можно пить воду без газа.
» [«opisanie»]=> string(12438) «
Метод исследования: Определение нуклеотидной последовательности соответствующих генетических локусов методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Исследование полиморфизмов в генах:
- F2 (протромбин, 20210, G>A), rs1799963
- F5 (мутация Лейдена, R534Q, G>A), rs6025
- F7 (коагуляционный фактор VII, R353Q, G>A), rs6046
- FGB (фибриногенA), rs1800790
- SERPINE1 или PAI-1 (ингибитор активатора плазминогена, – 675, 5G>4G), rs1799768
Полиморфизмы в генах, кодирующие плазменные факторы системы свертывания крови повышают вероятность возникновения венозных тромбозов и связанных с ними осложнений, в первую очередь, в венах нижних конечностей, а также в мозговых, брыжеечных, печеночных и портальной венах.
Одновременное выявление нескольких генетических факторов предрасположенности к тромбофилическим состояниям значительно увеличивает риск развития тромбозов.
Знание о наличии у человека врожденной тромбофилии, смешанной тромбофилии или просто повышенного генетического риска тромбообразования существенно влияет:
- на предоперационную подготовку и ведение послеоперационного периода;
- на подготовку и ведение беременности и родов;
- на разработку индивидуальной профилактики тромбоза и назначение ряда препаратов и пр.
Необходимо помнить о дополнительных факторах, повышающих риск развития тромбофилии:
- повышенное артериальное давление;
- склеротические изменения сосудов;
- повышенный уровень холестерина;
- вредные привычки (злоупотребление спиртными напитками, курением и др.);
- тяжелые патологические процессы и заболевания (злокачественные опухоли, лучевая болезнь, заболевания внутренних органов, в особенности печени).
Данное исследование направлено на выявление полиморфных мутаций в генах, активизирующих или деактивирующих различные звенья свертывающей системы крови и повышающих или снижающих вероятность образования венозных тромбозов.
Определение нуклеотидной последовательности соответствующих генетических локусов проводится методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Преимущества метода:
- высокая прогностическая значимость выявляемых факторов риска;
- точность определения генотипа;
- анализ на наличие мутаций достаточно провести 1 раз в жизни.
Показания к исследованию:
- Досимптоматическое определение риска развития венозных тромбозов;
- Повторные случаи венозных тромбоэмболий;
- Первый эпизод венозных тромбоэмболий в возрасте до 50 лет;
- Первый эпизод венозных тромбоэмболий при отсутствии средовых факторов риска в любом возрасте;
- Первый эпизод венозных тромбоэмболий с необычной анатомической локализацией (мозговые, брыжеечные, печеночные, портальная вены и т.д.);
- Первый эпизод венозных тромбоэмболий у лиц в любом возрасте, имеющих родственников первой степени родства (родители, дети, сестры, братья) с тромбозами до 50 лет;
- Первый эпизод венозных тромбоэмболий, возникший во время беременности, в послеродовом периоде или во время приема оральных контрацептивов;
- Необъяснимая внутриутробная гибель плода во время второго или третьего триместра беременности, нарушения структуры и функции плаценты, патология родов, задержка развития плода;
- Первый эпизод венозных тромбоэмболий, при приеме заместительной гормональной терапии;
- Ишемическая болезнь сердца, артериальная гипертензия, атеросклероз или венозный тромбоз;
- Антифосфолипидный синдром.
Интерпретация результатов:
Для каждого полиморфизма в бланке ответа в графе «Результат» указывается его аллельное состояние: «Гетерозигота» или «Гомозигота».
Пример результата исследования. Полиморфизмы в генах, кодирующие плазменные факторы системы свертывания крови
| Полиморфизм в гене F2 (протромбин, 20210, G>A), rs1799963 | GA |
| Полиморфизм в гене F5 (мутация Лейдена, R534Q, G>A), rs6025 | AA |
| Полиморфизм в гене F7 (коагуляционный фактор VII, R353Q, G>A), rs6046 | GG |
| Полиморфизм в гене FGB (фибриноген, 455,G>A), rs1800790 | AA |
| Полиморфизм в гене SERPINE1 (ингибитор активатора плазминогена, – 675, 5G>4G), rs1799768 | 5G/4G |
Анализ: генетическая тромбофилия или полиморфизм генов

Часто читатели задают вопрос: какой «анализ на тромбофилию» надо сдать, если есть склонность к тромбозам, или тромбозы были в семье. Про анализы при «генетической тромбофилии» и про «полиморфизм генов» подробно рассказывает врач Власенко Наталья Александровна
Врожденная или генетическая тромбофилия
Если коротко, то список рекомендованных анализов на генетическую тромбофилию включает перечисленные стандартные тесты, а при особых показаниях могут быть исследованы некоторые другие генетические факторы. Подробнее на сайте www.pynny. ru
Нажмите на таблицу для увеличения
Как же распознать генетическую тромбофилию?
Подобные диагнозы и последующее лечение определяет врач – человек, который учился этому 6-7 лет, а не “знатоки” на форумах.
Собрать анамнез, выяснить жалобы, провести осмотр – это то, что может сделать доктор на приеме. Но для постановки диагноза “генетическая тромбофилия” этого мало. Обязательно нужно сдать лабораторные анализы на тромбофилию.
Даже название заболевания нам “сообщает”, что консультация генетика необходима. Подразумевается, что в каком-то гене есть аномалия, которая определяет склонность к томбообразованию. Задача врача-генетика выяснить в каком именно гене это произошло с помощью лабораторого обследования.
Чтобы не возникало сомнений в необходимости подтверждения диагноза и лечения генетической томбофилии, нужно понимать: почему?
Для здоровья опасна не сама тромбофилия, а ее осложнения (инфаркт, инсульт, ТЭЛА, тромбоз мезентериальных сосудов и др.).
Во-первых, изменить генотип мы не можем, поэтому с наличием генетической тромбофилии нужно смириться.
Во-вторых, эндогенные и экзогенные факторы могут способствовать “старту” тромбофилии. То есть, если генетическая предрасположенность есть, то определенные факторы могут спровоцировать развитие этого состояния. Поэтому, о наличии своих особенностях в генах надо знать, чтобы понимать насколько опасны/полезны могут быть совершенные действия.
В-третьих, при оперативном вмешательстве или инвазивном обследовании отсутствие информации о наличии генетической тромбофилии может значительно повлиять на исход мероприятия.
В-четвертых, предупредить заболевание гораздо проще, чем лечить. Поэтому, разумно корректируя двигательную активность и подбирая правильно рацион питания, ведется профилактика осложнений тромбофилии.
В пятых, для каждой причины тромбофилии, подбирается индивидуальное лечение. Поэтому, консультироваться у доктора и сдавать анализы необходимо.
Анализы на генетическую тромбофилию
Сначала сдаются неспецифические анализы крови (первый этап), исследования, которые используются для диагностики не только тромбофилии. Они определяют, что есть нарушения в системе свертывания крови.
Это общий анализ крови, АЧТВ, определение Д-димера, количественное исследование антитромбина III, фибриногена.
При подозрении на тромбофилию в общем анализе должен насторожить повышенный уровень эритроцитов и тромбоцитов.
Активированное частичное тромбопластиновое время АЧТВ – временной интервал, за который образуется сгусток. Этот показатель определяет степень активности факторов свертывания. Снижение этого показателя крови может свидетельствовать о тромбофилии.Д-димер – вещество, которое образуется при разрушении тромба, результат расщепления фибрина.
Его наличие в крови возможно при фибринолизе и тромбообразовании. По сути, это маркер этих процессов. При тромбофилии, соответственно, его количество увеличится.
Уровень антитромбина III также будет занижен, так как именно он активирует противосвертывающую систему крови. По названию понятно, что этот белок
препятствует образованию тромбов в кровяном русле.
Фибриноген – белок, вырабатываемый печенью. Он является основой для образования тромба. Процесс выглядит так: фибриноген-фибрин-тромб.
При тромбофилии показатель повышен.
Второй этап – это специфические исследования: уровень волчаночного коагулянта, антифосфолипидные антитела, уровень гомоцистеина, а также генетические исследования.
Они позволяют дифференцировать тробмофилию с другими заболеваниями.
Волчаночный антикоагулянт – это специфический белок, который разрушает клеточные мембаны сосудов, прикрепляясь к ним, он начинает участвовать в процессе свертывания крови, провоцируя тромбозы. ВА является иммуноглобалином, это антитело против фосфолипидов. Его появление возможно при аутоиммунных процессах.
Антифосфолипидные антитела. Их несколько видов и наименований (и в том числе – волчаночный антикоагулянт). Они также способны разрушать клеточные мембраны. При увеличении их количества можно думать об антифосфолипидном синдроме.
Высокий гомоцистеин встречается и при гиповитаминозе вит. группы В, адинамии, злоупотреблении никотином.
Полиморфизм генов тромбофилии
Генетические исследования при тромбофилии – это отдельный разговор.
Существует понятие «полиморфизм генов». Чтобы понимать для чего нужен анализ на генетическую тромбофилию, нужно знать, что конкретно мы исследуем.
Полиморфизм генов – это разнообразие генов. Если сказать точнее, то один ген может быть представлен несколькими вариантами (аллелями).
На молекулярном уровне это выглядит, как “поезд с вагонами”, где поезд – это ген, а вагоны – нуклеотиды ДНК. Когда “вагоны” выпадают из состава или меняют свою последовательность – это полиморфизм генов. И вариаций может быть миллион.
Предрасположенность к генетической тромбофилии определяют определенные гены, точнее их мутации, аномальные изменения. Для подтверждения или исключения диагноза проводят комплексное обследование. Все гены, которые “заинтересованы” (могут влиять) на развитие болезни исследуются на молекулярном уровне.Для определения полиморфизма генов берут на анализ либо кровь, либо эпителий со щеки. Обычно исследуется 8 (минимум) – 14 полиморфизмов.
Самые распространенные мутации
- полиморфизм пятого фактора свертывания крови (фактор Лейдена);В мутантном гене происходит замещение гуанина на аденин, как следствие, меняются свойства аминокислоты. Наследуется по аутосомно-доминантному типу;
- мутация второго фактора свертывания крови (протромбин).Также замещается аденином гуанин, но в другой позиции.Этот полиморфизм может иметь значение для прогноза заболевания у пациентов, принимающих гормональные препараты;
- полиморфизм I фактора свертываемости крови – фибриногена. В норме фибриноген превращается в фибрин, затем происходит образование тромба.При этой мутации процент фибриногена выше, что увеличивает риск образования тромба;
- полиморфизм седьмого фактора свертывания крови. Является ферментом, активатором IX и X факторов. С помощьюседьмого фактора происходит образование кровяного сгустка. Когда активируется X фактор, то одновременно происходит активация протромбина, который после превращается в тромбин;
- полиморфизм XII фактора свертывания крови характеризуется снижением активности фермента. Из-за этого “качество” фибриновых волокон и сгустка страдает, и фибринолиз происходит быстрее;
- аномалии тромбоцитарных рецепторов к коллагену и фибриногену. При изменении свойств рецепторов увеличивается скорость адгезии тромбоцитов и происходит гиперагрегация тромбоцитов. Такой полиморфизм страшен риском ТЭЛА, инфаркта, невынашиванием беременности, послеоперационными тромбозами.
- антагонист активатора плазминогена изменяет эффективность активации плазминогена, подавляет процесс фибринолиза.Изменяется количество повторов гуанина. Бывает 5 последовательностей повторов оснований гуанина (5G) и 4 повтора оснований гуанина (4G). Второй вариант имеет неблагоприятное прогностическое значение;
- полиморфизмы дефицита протеинов С и S. Эти два “брата-протеины” являются ингибиторами тромбообразования, то есть препятствуют ему. При их дефиците – тромбы образуются активнее.Протеины С и S “работают в команде”. Их основная цель – разрушить V и VIIIфакторы свертываемости крови, чтобы предотвратить выпадение фибрина. Протеин S является кофактором протеина C.
Сейчас такие информативные генетические обследования доступны каждому пациенту. Бережное и внимательное отношение к своему здоровью – залог прекрасного качества жизни независимо от возраста!
Анализы в KDL. Генетический риск нарушений системы свертывания

Данное исследование представляет собой выявление полиморфизмов в генах, связанных с наследственной тромбофилией и другими нарушениями системы свертывания крови. Тромбофилия – это повышенная склонность к случайному (без видимых причин) тромбозу глубоких вен и тромбоэмболическим осложнениям.
Тромбоз может возникнуть при нарушениях кровообращения (застой крови), повышенной способности крови образовывать тромбы (гиперкоагуляции), повреждениях сосудистой стенки и при сочетании этих факторов.
Гиперкоагуляция может быть обусловлена наличием генетической предрасположенности к тромбофилии (наиболее часто встречаются полиморфизмы в генах F2 и F5), которую позволяет выявить этот анализ.
В каких случаях обычно назначают исследование?
Анализ рекомендован следующим категориям пациентов:
- пациенты с семейной историей тромбофилии и других венозных осложнений
- пациенты с наличием в семейной истории сердечно- сосудистых событий (инфарктов и инсультов) у близких родственников в возрасте до 50 лет
- женщины, планирующие прием комбинированных
- пациенты с тромбозами любой локализации в возрасте до 50 лет, даже при наличии предрасполагающих факторов
- пациенты с тромбозами необычных мест (тромбоз мозговых синусов, мезентериальные, печеночные вены)
- пациенты с хроническими заболеваниями вен, в частности с тромбофлебитами
- женщины, планирующие прием комбинированных оральных контрацептивов
- женщины, планирующие гормональную заместительную терапию
- женщины с привычным невынашиванием беременности.
Что именно определяется в процессе анализа?
В данном исследовании выявляются полиморфизмы следующих генов:
- F2 — ген протромбина.
- F5 – ген фактора V свертывания крови.
- F7 – ген проконвертина.
- F13A1 – ген, кодирующий A-субъединицу XIII фактора свертывания.
- FGB – ген, кодирующий бета- субъединицу фибриногена.
- ITGA2 – ген, кодирующий тромбоцитарный гликопротеин Iа.
- ITGB3 – ген, кодирующий белок интегрин бета- 3, являющийся компонентом тромбоцитарного гликопротеина IIb/IIIа.
- SERPINE1 (PAI-I)– ген ингибитора активатора плазминогена 1 типа.
Что означают результаты теста?
В качестве заключения выдается генетическая карта здоровья, составленная профессиональным врачом-генетиком нашей лаборатории.
В ней представлены результаты анализа с расшифровкой, дано подробное описание исследуемых полиморфизмов и их влияния на риски развития нарушений системы свертывания крови, сердечно-сосудистых заболеваний и патологий беременности, советы по проведению дополнительных исследований и подробные клинические рекомендации для лечащего врача.
Результаты анализа интерпретируются лечащим врачом. Опираясь на них, врач может скорректировать питание и образ жизни пациента, назначить лекарственные препараты и дополнительные исследования.
Сроки выполнения теста
Результат генетического исследования можно получить спустя 10-11 дней после взятия крови.
Как подготовиться к анализу?
Следует придерживаться общих правил подготовки к взятию крови из вены. Кровь можно сдавать не ранее, чем через 3 часа после приема пищи в течение дня, или утром натощак. Чистую воду можно пить в обычном режиме.
Можно сдавать кровь в течение дня, не ранее, чем через 3 часа после приема пищи или утром натощак. Чистую воду можно пить в обычном режиме.
Выдается заключение в виде Генетической карты здоровья
Исследование входит в состав
Не нашли офиса рядом? Закажите услугу «Выезд на дом». подробнее пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
Сегодня работает до 20:00
пн-пт: 7:00-20:00сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
Сегодня работает до 20:00
пн-пт: 7:00-20:00сб: 7:30-16:30
вс: 7:30-14:30
Сегодня работает до 20:00
пн-пт: 7:00-20:00сб: 7:00-17:00
вс: 7:00-15:00
Сегодня работает до 20:00
пн-пт: 7:00-20:00сб: 7:30-16:30
вс: 7:30-14:30
Сегодня работает до 20:00
пн-пт: 7:00-20:00сб: 7:00-17:00
вс: 7:00-15:00
Сегодня работает до 20:00
пн-пт: 7:00-20:00сб: 7:30-16:30
вс: 7:30-14:30
Сегодня работает до 20:00
Сегодня работает до 20:00
пн-пт: 7:00-20:00
сб-вс: 7:30-19:30
пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:00-19:00сб: 7:30-16:30
вс: 7:30-14:30
Сегодня работает до 20:00
пн-пт: 7:00-20:00сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:30-19:30сб: 7:30-16:30
вс: 7:30-14:30
пн-пт: 7:00-19:00сб: 7:30-15:30
вс: 7:30-13:30
пн-пт: 7:00-19:00сб: 7:30-15:30
вс: 7:30-13:30
Генетические анализы при потерях беременности
Aнализы на генетические полиморфизмы при выкидышах и замерших беременностях в первом триместре
Поскольку 80%[1] потерь приходятся на первые три месяца беременности, только этих ситуаций мы коснемся в статье. Причины потери беременности после 12 недель – предмет отдельного обсуждения.
Непросто поверить, но риск спонтанного прерывания беременности на сроке 6-12 недель у здоровой женщины моложе 35 лет составляет не менее 10%[2], и повлиять на причины этих событий можно в меньшинстве случаев.
Итак, женщина понимает: ребенка не будет. Одно из первых желаний в такие моменты – узнать причину. И находятся желающие эту потребность удовлетворить: ошарашенной женщине назначают многочисленные обследования и анализы, и редко обходится без тестов на:
- «генетические причины потери беременности»
- «полиморфизмы в генах гемостаза и фолатного цикла»
- «мутации предрасположенности к невынашиванию беременности»
- «генетический риск осложнений беременности»
- …
Вариантов названий у этой услуги множество. Суть одна: по материалу матери определяют ее генотип по полиморфизмам нескольких генов.
Когда женщине назначают «генетические анализы» по поводу потери беременности — это в 99% случаев именно анализы на полиморфизмы. Поэтому (с определенным допущением) можно сказать, что анализы на полиморфизмы = генетические анализы, которые назначаются женщинам по поводу потери беременности.
| Непросто в двух словах рассказать, что такое полиморфизмы. Полиморфизмы – это незначительные различия в структуре генов, определяющие разнообразие их проявлений. Каждый конкретный полиморфизм «живёт» в определенном гене, немножко изменяя свойства его продукта и, тем самым, проявление какого-то признака.Полиморфизмы – это то, что делает нас разными. Это генетические оттенки, из-за которых один может за милую душу выпить литр молока, а другой после пары глотков будет искать туалет. Благодаря полиморфизмам у нас столько цветов глаз и волос. Из-за них у кого-то кровь сворачивается чуть быстрее среднего, а у кого-то – чуть медленнее. Удивительно, но весь этот спектр форм, цветов и особенностей задается комбинациями четырех букв-нуклеотидов, составляющих наши гены: A, G, T и C. Одну букву мы получаем от мамы, другую – от папы. Так получается наш собственный генотип: например GG, GA или TC. Результатом анализа на полиморфизмы как раз и будут пары букв.Например, в гене фактора свертывания крови V (этот ген называется F5) буквой под номером 1691 может быть G, а может – А. Отсюда три варианта генотипов: GG, GA и AA. Вариант GG — удел большинства людей, ему не свойственны какие-то особенности. Около 2-7% людей имеют генотип GА, то есть несут полиморфизм А (так называемую Лейденскую мутацию), из-за чего склонны к повышенной свертываемости крови. Людей с генотипом АА крайне мало.Грань между понятием «мутация» и «полиморфизм» тонка и неопределенна. Ученые-биологи любое отклонение от «эталона» могут называть мутацией, а врачи-практики обычно считают мутацией только то изменение, которое может приводить к болезни. Поэтому не смущайтесь, что полиморфизм в гене F5 называют Лейденской мутацией. |
Какие полиморфизмы обычно обсуждаются в контексте потери беременности?
Назовём героев этой статьи поимённо!
Не пугайтесь того, что эти названия вам ни о чем не говорят, и пока что поверьте: они и врачу вашему в большинстве случаев ничего не скажут.
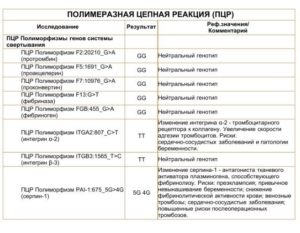
- F5: 1691 G>A (Arg506Gln)NB!
- F2: 20210 G>A NB!
- F7: 10976 G>A (Arg353Gln)
- F13: G>T (Val34Leu)
- FGB: -455 G>A
- ITGA2: 807 C>T (Phe224Phe)
- ITGB3: 1565 T>C (Leu33Pro)
- SERPINE1 (PAI-1): -675 5G>4G
- MTHFR: 677 C>T (Ala222Val)
- MTHFR: 1298 A>C (Glu429Ala)
- MTR: 2756 A>G (Asp919Gly)
- MTRR: 66 A>G (lle22Met)
NB! Обратите внимание, что эти два полиморфизма могут играть важную роль в принятии решения о назначении КОК (комбинированных оральных контрацептивов).
Почему врачи назначают анализы на эти полиморфизмы?
Когда ученые узнали о существовании полиморфизмов, они задумались: а нельзя ли использовать это знание для выделения группы людей с предрасположенностью к определенным заболеваниям, и заблаговременно их предупреждать? Известно же: предупредить легче, чем лечить!
Эти времена совпали с подъемом молекулярных технологий, позволивших выполнять тесты на полиморфизмы относительно просто и недорого. Исследователи смекнули, что работы типа «Влияние полиморфизма Х на болезнь Y» генерировать легко и делать это можно практически бесконечно.
Поскольку болезней и полиморфизмов много, всегда была возможность подобрать пару «полиморфизм – болезнь», позволявшую даже из безнадежных данных вытащить мало-мальски значимую связь и опубликоваться, кокетливо умолчав об изъянах дизайна исследования.
Соедините немного логики и статистики – и получите скромное, но научное достижение.
Вот как рассуждали эти исследователи: уже упоминавшаяся Лейденская мутация связана с повышенной свертываемостью крови. Известно, что формирование и функционирование плаценты сильно зависит от агрегатных свойств крови, а при невынашивании беременности в плацентах нередко находят очаги тромбоза.
Логично предположить, что у носительниц Лейденской мутации эти нарушения могут встречаться чаще. Осталось провести исследование и проверить эту гипотезу. Такие исследования были проведены и некоторые показали наличие связи между наличием Лейденской мутации и повышенным риском потери беременности.
Так появилась богатая (на немалую долю отечественная) «литературная база», указывающая на связь между полиморфизмами и предрасположенностью к разным болезням.
Именно на эту «базу» опирались производители реагентов при убеждении врачей в целесообразности назначения тестов на полиморфизмы.Да-да, на определенном этапе потребность в диагностикумах для анализов на полиморфизмы стала так велика, что привлекла производителей реагентов, которые создали коммерческие наборы для выполнения этих тестов. А товар требует продвижения.
Как можно расширить рынок таких наборов? Внедрить тесты на полиморфизмы в клиническую практику! И эти анализы из научных лабораторий стали «заползать» в диагностические.
Когда результаты научных исследований переносятся в клиническую практику без должной оценки последствий, страдают кошельки и нервы пациентов.
Так появились лаборатории, предлагающие тесты на полиморфизмы как медицинские диагностические услуги. Так появились врачи, наученные лабораториями и производителями реагентов, что эти тесты нужно назначать в различных случаях, в том числе при невынашивании беременности. Так сформировалась целая мифология про то, какие полиморфизмы надо выявлять и как их «лечить».
1. Полиморфизмы не являются значимой причиной ранней потери беременности
Около 70% беременностей, прервавшихся в первом триместре, не могли развиваться из-за генетических аномалий ЭМБРИОНА (не матери!!!)[3]. Не путайте с генетическими полиморфизмами!
Полиморфизмы – это генетические особенности мамы, а приводящие к выкидышу нарушения структуры и количества хромосом – это грубые аномалии эмбриона. Возникновение таких эмбрионов – часть жизни, так же, как и их ранняя отбраковка.
Оставшиеся 30% ранних потерь беременности тоже не имеют отношения к полиморфизмам, а обусловлены антифосфолипидным синдромом, неправильным функционированием шейки матки, инфекциями и другими причинами, к которым генетические полиморфизмы матери не относятся.
2. Какие-то полиморфизмы есть у всех людей
В отличие от мутаций, вызывающих редкие генетические болезни, которые встречаются у одного из десятков тысяч людей, какие-то полиморфизмы есть у всех. Каждый день мимо вас проходят люди с такими же GG, GA и TC, как у вас.
Возможно, у них есть дети, но может быть и нет. Есть вероятность, что они сталкивались с потерей беременности, а может быть их это несчастье обошло стороной.
В любом случае: от вас они отличаются тем, что не тратили деньги на анализ полиморфизмов.
3. Полиморфизмы не определяют признак полностью (или на большую часть)
Вернемся к несчастным больным генетическими заболеваниями: их редкий генетический дефект практически на 100% определяет их беду. То, что генетики называют «факторами среды» (поведение, питание, физическая активность) вносит очень маленький вклад в их несчастье. С полиморфизмами наоборот: их вклад очень мал.
Например, вероятность развития венозного тромбоза хоть в некоторой степени и зависит от наличия, например, уже знакомой нам Лейденской мутации, но на львиную долю определяется весом, статусом курения, возрастом, наличием беременности, принимаемыми препаратами и другими факторами.
4. Полиморфизм – не болезнь
Какими бы жуткими словами не сопровождались комбинации из букв A, G, T и C в заключении генетического анализа, они НЕ говорят о том, что у женщины будет, например, «невынашивание беременности».
Пример из жизни:
Когда на бланке результата «Нарушение развития плода – незаращение нервной трубки» написано рядом с «MTRR c.66A>G G/G» любой человек поймёт такую запись как причинно-следственную связь. А это не так.
Наличие полиморфизмов говорит лишь о том, что вы принадлежите к людям, у которых по данным некоторых(!) научных(!!!) исследований эти патологии возникают чаще, чем у людей без ваших полиморфизмов.
И тут мы переходим к следующему факту…
5. Влияние полиморфизмов «видно» только на больших группах людей
Даже будучи специалистом, я не пойму ваш генотип по генам свертывания крови, увидев вашу коагулограмму (анализ на свертываемость крови). А всё потому, что эти различия не «видны» на индивидуальном уровне.
У человека с «плохими» полиморфизмами свертывание может быть «лучше», чем у «генетически идеального».
Лишь среднее значение этого показателя, измеренное в большой группе людей с «плохим» генотипом, будет отличаться от такового у группы с «хорошим».
| Немного математики: Иногда в заключении анализа рядом с жуткими «диагнозами» можно увидеть цифры. Например, «Выявленный полиморфизм в 3,5…5,5 раз увеличивает риск венозной тромбоэмболии». Эти цифры – совершенно честные[4] для Лейденской мутации. Этот полиморфизм – один из двух достойных хоть какого-то внимания полиморфизмов системы свертывания крови. Второй – так называемый «полиморфизм протромбина», c.20210G>A в гене фактора свертывания крови II (F2).Но вернемся к цифрам. Увеличение в 3,5…5,5 раз – это существенно? Конечно существенно! Если мне завтра в три с половиной раза увеличат зарплату, это будет ой как существенно…А если посмотреть не относительный, а абсолютный риск? Когда у вас есть Лейденская мутация, ваш ежегодный риск получить венозную тромбоэмболию равен 0,05…0,2%. Иными словами:Наличие Лейденской мутации означает,что с вероятностью 99,95…99,80% у васНЕ будет венозной тромбоэмболии (ВТЭ) в течение следующего годаАбсолютный риск ВТЭ настолько мал, что даже увеличение в разы не делает его существенным для жизни отдельного конкретного человека. Беременность в совокупности с Лейденской мутацией повышает риск ВТЭ, но шанс на то, что тромбоза НЕ будет, всё равно не опускается ниже 95%. |
1. «Вылечить» полиморфизмы нельзя
Это часть генотипа, и он останется неизменным до конца жизни. Поэтому тактика «сдать на полиморфизмы – полечить – сдать контрольный анализ» абсурдна по своей сути.
2. Ни один из полиморфизмов не является прямым поводом для назначения лечения
Справедливости ради, стоит отметить, что при невынашивании беременности антикоагулянтная терапия может потребоваться, и она дает неплохие результаты. Но для назначения антикоагулянтов должен быть установлен диагноз «антифосфолипидный синдром» (который может сочетаться или не сочетаться с полиморфизмами в генах системы свертывания).
3. Курантил, актовегин, тромбоасс, пиявки не нужны
Они не имеют доказанной эффективности в улучшении исходов беременности у женщин с полиморфизмами в системе свертывания.
Тестирование женщин даже с неоднократной потерей беременности на наследственные тромбофилии[5] и полиморфизмы фолатного цикла[6] не входит в рекомендации ведущих медицинских организаций, занимающихся этой проблемой. Но в большинстве отечественных «методичек» и рекомендаций по невынашиванию беременности эти исследования входят.
И чтобы не оставлять неопределенности:
Анализы на генетические полиморфизмы женщинам, столкнувшимся с потерей беременности один или несколько раз, делать не нужно
Источники:
[1]https://www.acog.org/Resources-And-Publications/Practice-Bulletins/Committee-on-Practice-Bulletins-Gynecology/Early-Pregnancy-Loss [2] https://www.webmd.com/baby/guide/pregnancy-miscarriage#1 [3] http://emedicine.medscape.com/article/260495-overview#a11 [4] Scott M. Stevens et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis (2016) 41:154–164 [5] Evaluation and treatment of recurrent pregnancy loss: a committee opinion [6] Thrombophilias and recurrent pregnancy loss: a critical appraisal of the literatureКарпачева Клавдия, молекулярный генетик
Свертываемость крови как признак наследственной патологии
Нарушения гемостаза имеют врожденный и приобретенный характер. Те, которые передались по наследству, являются генетическими. Такая патология приводит к усилению или уменьшению свертываемости крови, которая обычно наследуется как признак полиморфизма генов.
Первыми эту проблему чаще всего замечают акушеры-гинекологи, когда во время родов возникают коагулопатии. Также проблемы с системой гемостаза провоцируют внутриутробную гибель плода, привычное невынашивание беременности, ее осложнения или бесплодие, которая может быть обусловлена аутоиммунными заболеваниями родителей.
Поэтому на этапе планирования беременности необходимо пройти полное обследование, чтобы максимально устранить эти риски.
Полиморфизмы генов системы свертываемости крови
Врачи утверждают, что полиморфизмы генов системы свертываемости крови не всегда обуславливают патологию, но они отыгрывают значительную роль в ее развитии.
Поэтому при их обнаружении во время обследования будущих родителей информируют о том, что существует риск, который измеряется отношением возможности.
В западных странах обязательно во время беременности изучают мутации генов FV, F2, PAI-1, MTHFR.
Необходимо отметить, что свертывающая система крови – огромная совокупность всевозможных биохимических процессов, призванных поддерживать кровь в жидком состоянии, что обеспечивает нормальную ее вязкость и своевременную остановку кровотечений. Она содержит факторы, которые отвечают за свертываемость, кровоточивость и растворение тромбов. Нарушение такого гомеостаза за счет воздействия различных триггеров ведет за собой тяжелые осложнения, которые иногда очень тяжело остановить.Например, больной гемофилией может погибнуть от незначительного пореза, если ему не оказать медицинскую помощь, при этом гемофилией страдает достаточно большое количество людей. Инфаркты, ишемические инсульты или другие сосудистые катастрофы также имеет огромную долю летальных исходов, при этом они могут наследоваться либо формироваться по причине генетических мутаций и полиморфизмов.
Полиморфизм гена АСЕ
Этот ген оказывает влияние, по своей сути кодирует работу системы АПФ, занимающейся регуляцией артериального давления и нормального водно-солевого метаболизма. При проведении обследования у генетика, расшифровка укажет на два варианта – наличие и отсутствие интрона гена. Если его нет, то на треть повышается риск развития следующих заболеваний:
- гипертоническая болезнь;
- сосудистые катастрофы – инфаркты, инсульты, тромбозы;
- ТЭЛА;
- нефропатия.
Высокая свертываемость обусловлена снижением количества воды в циркуляторном русле. Для исследования берут цельную кровь, анализ проводится методом ПЦР или рестрикционно. Лечение полиморфизма зависит от развившейся патологии.
Полиморфизм коагуляционного фактора F5 V
Это заболевание также называют мутацией Лейден или симптомом наследственных нарушений свертывания крови. Оно связано с образованием тромбина, отображает риск венозных тромбозов.
Ее распространенность достигает 5%. 7-кратное увеличение риска наблюдается тогда, когда мутация определяется рецессивным геном, то есть речь идет о том, что возникла рецессивная мутация у гетерозигот.
При гомозиготности он увеличивается в 100 раз.
Существуют триггерные факторы по риску полиморфизма:
- прием таблетированных контрацептивов;
- беременность;
- заместительная терапия гормонами;
- оперативные вмешательства;
- наличие центрального венозного доступа (подключичная вена) анамнезе;
- гиподинамия;
- путешествия на самолетах;
- инфекции или онкологические процессы.
Наличие такой мутации провоцирует нарушение свретываемости крови, а также приводит к таким осложнениям беременности, как ранний выкидыш, задержка внутриутробного развития, гестоз и другие. Повышение свертываемости провоцирует артериальные эмболии и сосудистые катастрофы.
Читать также Особенности гемофилии у детей
Полиморфизм коагуляционного фактора F2 20210 G
Среди всего исследования, генетический анализ на второй фактор свертываемости или протромбин, является одним из самых важных. Он является предвестником тромбина.
При его недостатке состояние системы свертываемости ухудшается, что проявляется появлением кровотечений. Если же экспрессия гена повышена, то вместо плохой свертываемости крови развивается гиперкоагуляция.
Мутация наследуется аутосомно-доминантно. Носителями считается около 3% людей.
Клиническая картина включает бесплодие, гестозы, преэклампсия, привычное невышашивание беременности, а также задержка и нарушение внутриутробного развития со стороны репродуктивной системы. Со стороны коагулопатий чаще отмечается повышение риска тромбообразования и тромбозом, эмболий, что проявляется сосудистыми катастрофами. Лечение зависит от симптоматики.
Полиморфизм гена MTHFR C677T
Этот ген программирует последовательность фермента, участвующего в метаболических процессах фолиевой кислоты, которая играет большую роль в синтезе метионина и S-аденозилметионина.
При дефиците фермента активируются онкогены и клеточные гены, накапливается гомоцистеин. При беременности повышается воздействие тератогенных факторов, а вероятность рождения здорового ребенка снижается.
Если генотип материнского организма содержит такой полиморфизм, необходимо обязательно следовать всем рекомендациям генетика.
Полиморфизм имеет связь с заменой цитозина на тимин в 677 позиции, что влечет за собой замену остатка аланина на валин в позиции 223, которая отвечает за связывание фолиевой кислоты. У гомозигот теряется термолабильность, из-за чего происходит потеря активность в двух случаях из трех.
У гетерозигот отмечаются сердечно-сосудистые патологии, нарушения внутриутробного развития, рак половых органов. У гомозиготных женщин в период беременности отмечается нарушения внутриутробного развития плода, проявляющиеся патологией нервной трубки.
Усугубляется патология факторами внешней среды и вредными привычками.
Лечение патологических процессов симптоматическое.
Показания к проведению теста:
- гипергомоцистинемия;
- врожденные пороки нервной, сердечно-сосудистой и мочеполовой систем;
- хромосомный синдром при здоровых отце и матери;
- ишемическая болезнь сердца, гипертензия, в том числе наличие этих патологий у ближайших родственников;
- бесплодие, невынашивание беременности.
Исследуется цельная кровь, метод проведения анализа – ПЦР.
Полиморфизм коагуляционного фактора F7 ARG353GLN
Нормальные условия подразумевают то, что 7 и 3 факторы взаимодействуют, тем самым активируют работу фактора IX и X. То есть они все участвуют в формировании сгустка крови. Если развился полиморфизм F7 ARG353GLN, то снижается экспрессия гена, что снижает свертываемость.
Показанием к проведению данного анализа является изучение рисков сосудистых катастроф, а также тромбоэмболические процессы.
Симптоматика обуславливает гиперкоагуляцию, повышенный риск смерти по ее причине. Лечение такой мутации симптоматическое.
Полиморфизм тромбоцитарного рецептора фибриногена
Этот рецептор играет роль во взаимодействии тромбоцитов с фибриногеном, что обуславливает их повышенную агрегацию. Патология генетического кода подразумевает замену цитозана на тимин, из-за чего меняется аминокислота рецептора. Это приводит к изменению его свойств. Отмечается повышенная агрегация форменных элементов. Симптоматически встречаются:
- сосудистые катастрофы – инфаркты, инсульты;
- коронарный синдром;
- тромбозы.
Важно отметить, что люди, у которых была определена такая мутация, намного лучше реагируют на назначение антиагрегантной терапии аспирином или клопедогрелем.
Показания к проведению теста:
- тромбозы, тромбоэмболии у обследуемого или его ближайших родственников;
- сосудистые катастрофы;
- определение успешности атиагрегантной терапии.
Исследуется венозная кровь, определение происходит методом ПЦР.
Полиморфизм фибриногена 455G
Эта мутация приводит к повышению экспрессии гена, который отвечает за продукцию фибриногена. Показанием к анализу служат повышенные цифры фибриногена при изучении коагулограммы, сосудистые катастрофы анамнестически, артериальная гипертензия.
Клинически мутация проявляется тромбозами, кардиоваскулярными патологиями. Изменение уровня фибриногена развивается еще и на фоне приема лекарственных средств, алкоголизма, избыточной массы тела. Лечение симптоматическое, зависит от развившейся патологии.
Читать также Гепарин-индуцированная тромбоцитопения
Полиморфизм ARG353GNL 10976 GA коагуляционного фактора VII F7
Этот ген кодирует прокорвентин, являющийся синтезируюемым в печени белком, который активирует факторы 9, 10 и витамин К. При его недостатке может возникать заболевание гемофилия за счет воздействия фактора 7 на другие.
Хромосома аллельных генов не содержит аденина, что провоцирует изменение всех свойств фермента за счет замены аргинина глутамином. Аллель А встречается у каждого десятого европейца. При полиморфизме развиваются тромбоэмболические процессы, а также тромбозы – инфаркты, инсульты и другие сосудистые катастрофы.
Больные гемофилией, помимо дефицита факторов 8 и 9, могут содержать недостаточное количество фактора 7.
Проконвертин является 7м фактором свертывания крови. По своей сути это профермент, который зависит от витамина К. Его синтез происходит в печени, а главной функцией является активация десятого фактора.Большинство случаев мутации отыгрывают фунцкию защиты от тромбоэмболии. Замена аргинина глутамином приводит к пониженной свертываемости, что также положительно влияет на развитие инфаркта миокарда даже при выраженном атеросклерозе коронарных сосудов.
Полиморфизм IIEMET66 AG мутация редуктазы метионинсинтетазы
Фермент, кодируемый этим геном, воздействует на большинство процессов, которые связаны с перемещением метильной группы. Другой функцией ученые называют обратную трансформацию гомоцистеина в метонин, кофактором здесь выступает коболамин – витамин В12.
Полиморфизм обуславливается заменой аминокислот, за счет чего снижается нормальная активность фермента. Это ведет к повышению риска развития патологий внутриутробного формирования, в том числе нервной системы за счет незарощения нервной трубки.
Дефицит кобаламина значительно утяжеляет явления полиморфизма. Также усиливается гипергомоцистеинемия, если таковая была обусловлена дефектом 677СТ. Количество гомоцистеина увеличивается только при двойной мутации.
Риск появления на свет ребенка с трисомией по 21й хромосоме (болезнь Дауна) повышается до 4% при данной мутации.
Полиморфизм 675 5G4G мутация ингибитора активатора плазминогена PAI1
Белок считается одной из основных составляющей комплекса плазминоген-плазмин. PAI1 блокирует активаторы плазминогена, что определяет подверженность сосудистым катастрофам. Гомозиготный вариант считается одним из их факторов риска. Также стоит подчеркнуть то, что этот ген подвержен стрессу больше, чем все другие известные гены человека.
Клинически при варианте 4G повышается экспрессия гена и уровень PAI1. Это ведет к снижению активности тромболитической системы, что отображается повышенной вязкостью крови, тромбозами.
Риск их возникновения увеличивается почти вдвое.
При этом, согласно многочисленным исследованиям, он растет у тех пациентов, у которых встречался тромбоз внутренних органов и воротной вены, однако корреляция не была установлена.
Такой ген также встречался у лиц, страдающих ожирением. При этом речь идет о центральном, а не периферическом отложении жира.В некоторой мере это обусловлено тем, что такая патология является коморбидной для кардиоваскулярных заболеваний, считается одним из триггерных факторов атеросклероза, инфарктов или инсультов.
Поэтому полиморфизм, влияющий на уровень PAI1 дополнительно повышает риск относительно сердечно-сосудистых проблем.
Показания для проведения такого теста:
- тромбоз воротной вены, а также паренхиматозных или полых внутренних органов;
- наличие инфаркта миокарда в анамнезе или у ближайших родственников;
- острый коронарный синдром;
- ожирение;
- сахарный диабет типа 2.
Следует отметить, что лечение всех клинических проявлений генетических мутаций генов, кодирующих свертываемость крови, зависит от заболевания, которое развилось. Обычно назначается симптоматическая терапия, поскольку на мутацию повлиять никоим образом нельзя, лишь иногда ее можно предупредить, снизив влияние факторов окружающей среды, которые могут ее спровоцировать.
